Latentna toplota
- 3733
- 789
- Dexter Koch
Kaj je latentna toplota?
Latentna toplota je količina toplote, ki jo mora absorbirati ali odstraniti snovi, da spremeni fizično stanje ali fazo, pri čemer ohranja konstantno temperaturo med tem postopkom. Dobavljena ali sproščena toplota se ne kaže, v temperaturni variaciji se ne "počuti" kot običajno; Od tod tudi izraz latentne toplote.
Latentna beseda izvira iz latinske besede "latenns", kar pomeni skrito, tako da se latentna toplota obnaša, kot da ne obstaja, kadar je temperatura konstantna. Vendar obstaja: kar se zgodi, je, da se v celoti porabi pri spremembi faze ali fizičnega stanja.
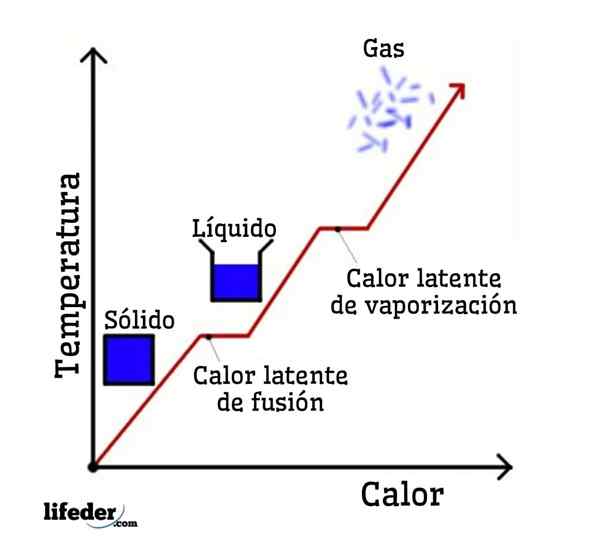
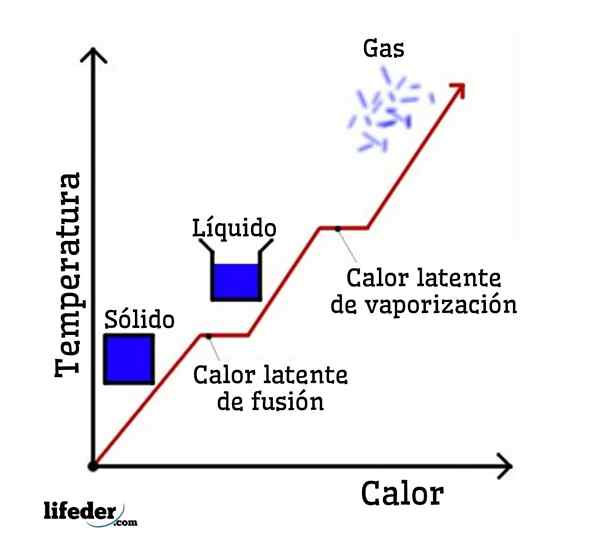
Če je voda vzeta kot primer, so fazne spremembe naslednje: led (trdna) se v procesu, imenovanem fuzija, stopi na tekočo (tekočo) vodo; in tekoča voda pa se izhlapi, da se pretvori v vodno paro (plin) v postopek, imenovan izparevanje.
Po drugi strani se vodna para ohladi v tekočo vodo v postopku, imenovanem kondenzacija; in tekoča voda spet postane led v postopku, imenovanem strjevanje.
Vsaka od teh faznih sprememb ima povezano z latentno toploto, ki je lahko pozitivna (absorpcija) ali negativna (sproščanje).
Latentna topna toplota
 Sprememba iz trdne v tekočino; fuzija
Sprememba iz trdne v tekočino; fuzija Količina toplote je treba dostaviti v določeno količino trdne snovi, da spremeni svoje fizično stanje iz trdne v tekočino. Med fuzijo ni spremembe temperature, tako da je trdna snov utemeljena ali taljenje tekočine, ki nastane iz njega, enaka temperatura kot celotna trdna snov.
Na splošno se ta toplota določi v normalni fuzijski točki, ki je temperatura, pri kateri se trdna snov začne združiti pod atmosferskim tlakom. Pri tej temperaturi je hkratno ravnovesje ali prisotnost v istem času trdnega stanja in tekočega stanja.
Vam lahko služi: kategorična spremenljivka: značilnosti in primeriZa trdno stanje je značilna prisotnost kompaktne strukture zaradi obstoja velikih -energijskih kemičnih vezi, ki mu dajo strukturno togost. Za preoblikovanje trdnih v tekočino je treba te interakcije prekiniti, zato se v ta namen porabijo (absorbirajo) energijo.
Tipičen primer je, ko zaužijemo sladoled, ki ga tvorijo voda, sladkor in druge snovi. Običajno je opaziti, da se sladoled, če ga ne zaužijemo hitro, začne topiti, torej se taliti. To se zgodi, ko temperatura sladoleda doseže točko taljenja ledu.
Primeri
Navedene bodo nekaj primerov latentne fuzijske toplote, izražene v j/g; to pomeni, da se mora energija, ki jo mora gram trdne snovi absorbirati, da se stopi na talilni točki:
-Led 334.0
-380 Aluminij.0
-Žveplo 38.1
-Baker 134.0
-Etanol 104.0
-Živo srebro 11.8
-Zlato 64.5
-Srebro 80.3
-Svinec 24.5
-Volfram 184
Led absorbira zelo toploto ne zato, ker so njene interakcije močnejše, ampak zato, ker je sposoben izjemno odvajati toploto med svojimi kristali.
Latentna toplota uparjanja
Količina toplote absorbira določeno količino snovi, da se premika iz tekočega stanja v plinasto stanje v normalni vrelišču. To pomeni, da se toplota absorbira, ko zavre in postane plin brez zvišanja temperature.
V naročju tekočine lahko molekule snovi medsebojno vplivajo na tvorbo vodikovih mostov in sili privlačnosti med molekulami. Če želite prenesti snov iz tekočega stanja v plinasto stanje, morate premagati te sile, zato morate oskrbovati toploto.
Občutljiva toplota postane tista, ki absorbira tekočino le za zvišanje temperature, kar bo odvisno od njegove specifične toplote. Medtem se latentna toplota izhlapevanja uporablja za pretvorbo neposredno v paro, postopek, ki je veliko lažji na vrelišču.
Lahko vam služi: kalibracijska krivulja: za kaj je, kako to storiti, primeriPrimeri
Spodaj so primeri nekaterih tekočin z njihovimi latentnimi ogrevanji izhlapevanja, ki se ponovno izraža v j/g:
-Ocetna kislina 402
-Aceton 518
-Voda 2256
-Etilni alkohol 846
-Žveplo 1510
-Benzen 390
-Ogljikov dioksid 574
-Klor 293
-Eter 377
-Glicerin 974
-Živo srebro 295
-Kisik 214
Upoštevajte ogromno latentno toploto tekoče vode: 1 g tekoče vode (približno 1 ml) mora absorbirati 2256 j, da se upari. Tekoča voda še vedno razprši toploto, ki jo prejme veliko bolje v primerjavi z ledom.
Latentna toplota za strjevanje
Toplota mora odpraviti določeno količino snovi, da se premika iz njegovega tekočega stanja v trdno stanje na mestu strjevanja ali zamrzovanja. Spet, dokler se tekočina ni popolnoma utrdila, bo temperatura ostala konstantna.
Postopek strjevanja je v postopku združitve obratno, zato so vrednosti latentne toplote strjevanja in vrednosti latentne toplote fuzije enake, vendar nasprotnih znakov.
Molekule snovi v tekoči državi se premikajo z nekaj svobode zaradi energije, ki jo imajo. Zato morajo molekule za premik v trdno fazo sprostiti energijo v obliki toplote, kar omogoča večjo interakcijo med molekulami snovi.
Interakcija med molekulami daje prednost tvorbi kemičnih vezi trdne faze. Primer tega se pojavi, ko se v zabojnike za tvorbo ledu v hladilniku postavi v hladilnik. Zamrzovalnik izvleče toploto iz tekoče vode in se utrdi, da postane led.
Primeri
Spodaj je nekaj primerov latentne ogrevanja za strjevanje (v j/g) za nekatere tekočine:
Vam lahko služi: bela luknja: zgodovina, teorija in kako se oblikuje-Voda (-334)
-Aluminij (-380)
-Žveplo (-38)
-Baker (-134)
-Etanol (-104)
Latentna kondenzacijska toplota
Količina toplote je treba sprostiti ali sprostiti iz določene količine snovi, da se premaknete iz plinskega stanja v tekoči stanje. Plin, ki je kondenziran in oblikovana tekočina med kondenzacijo vzdržuje isto temperaturo.
Kondenzacija je postopek v nasprotju z uparjanjem. Latentna kondenzacijska toplota ima enako vrednost kot latentna toplota uparjanja, vendar z nasprotnim znakom in na vrelišču. Primer tega je, ko je kuhana in je para kondenzirana na notranji strani loncev.
Plinaste molekule se prosto gibljejo z energijo, ki jo imajo. Zato morajo sprostiti energijo, da se med molekulami snovi lahko vzpostavijo medmolekularne interakcije tekočega stanja.
V naravi obstaja veliko drugih primerov pojava kondenzacije vode. Vodna para se vzpenja v ozračju in kondenzira v oblakih v obliki kapljic vode.
Obstaja tudi prisotnost kapljic vode v kozarcu avtomobilov, produkt kondenzacije vode zaradi temperaturnega znižanja zgodnjega jutra, ki predstavlja tako imenovani rocío.
Primeri
Končno se njihova latentna kondenzacija še enkrat izrazi, v j/g: bo navedena za nekatere hlape:
-Ocetna kislina (-402)
-Aceton (-518)
-Voda (-2256)
-Etilni alkohol (-846)
-Žveplo (-1510)
-Benzen (-390)
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Walter J. Moore. (1963). Fizikalna kemija. V kemični kinetiki. Četrta izdaja, Longmans.
- Wikipedija. (2020). Latentna toplota. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (2020). Latentna toplota. Okrevano od: Britannica.com
- Inženirsko orodje. (2003). Tekočine: latentna toplota izhlapevanja. Pridobljeno iz: EngineringToolbox.com
- Lumen učenje. (s.F.). Fazna sprememba in toplota. Obnovi se od: tečajev.Lumenarning.com

