Uravnoteženje kemijskih enačb
- 4658
- 1287
- Don Nitzsche
Kakšno je uravnoteženje kemijskih enačb?
Uravnoteženje kemijskih enačb je matematična operacija, ki se izvaja za ohranjanje zakona o ohranjanju snovi v reakcijah. Zadeva ni ustvarjena ali uničena. Zato mora biti število atomov pred in po kemični reakciji enako, tako v reagentih kot v izdelkih.
Če želite uravnotežiti kemično enačbo, morate prešteti atome pred in po puščici. Če številke sovpadajo, to pomeni, da je reakcija uravnotežena. V nasprotnem primeru se bo treba ujemati s temi številkami s spreminjanjem stehiometričnih koeficientov s preskušanjem in napakami, kar je najpreprostejša in najbolj intuitivna metoda za ravnotežje.
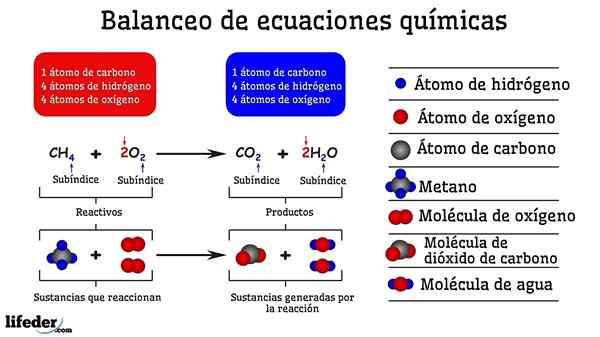
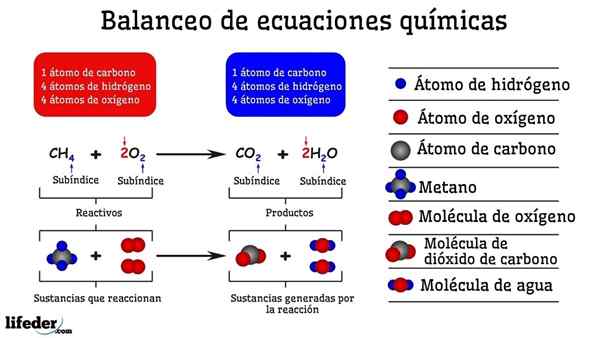 Primer kemijskega uravnoteženja reakcije med metanom in dvema molekulama kisika
Primer kemijskega uravnoteženja reakcije med metanom in dvema molekulama kisika Ko je uravnotežen s preskušanjem in napakami, je tako, kot da bi jih odstranili ali dodali atome na eni od obeh strani Subbaje. Dokler subbaja ni suspendirana vodoravno, kemična enačba ne bo popolnoma uravnotežena. Na katere koli strani ne more biti več (ustvarite snov) ali manj atomov (uniči snov).
Enostavni uravnotežilni primeri enačb
V naslednjih primerih boste videli uravnotežene ali enostavno uravnotežiti kemijske enačbe. Vsi morajo imeti skupno, da bo število atomov za vsak element enako pred in po puščici, ko bo kemična enačba uravnotežena.
Oksidacija živega srebra
2Hg +o2 → Hg2Tudi2
Imamo dva elementa: živo srebro (HG) in kisik (O). Število njihovih atomov izražamo pred (reagenti) in nato (izdelki) puščice:
HG: 2 (levo) - 2 (desno)
Lahko vam služi: molarna frakcija: kako je izračunana, primeri, vajeO: 2 (levo) - 2 (desno)
Enačba je uravnotežena, ker so atomi Hg ali so enaki na obeh straneh puščice.
Izgorevanje vodika
H2 + Tudi2 → H2Tudi
Spet imamo dva elementa: vodik (H) in kisik (O). Ponovitev prejšnjega koraka:
H: 2 - 2
O: 2 - 1
Na levi strani je kisik več kot v desni. Zato moramo dodati še en pravi kisik. Da bi to naredili, spreminjamo stehiometrične koeficiente, ki so številke, ki spremljajo in pred formulami. Če postavimo 2 pred h2Ali nam bo dal:
H2 + Tudi2 → 2H2Tudi
H: 2 - 4
O: 2 - 2
Kisik je uravnotežen. Ne pa vodiki. Zdaj morate dodati dva vodika na levo:
2H2 + Tudi2 → 2H2Tudi
H: 4 - 4
O: 2 - 2
In enačba je končno uravnotežena: isto število H ali pred in po in po puščici.
Upoštevajte, da stehiometrični koeficienti (2 za h2 in 1 za o2) pomnožite naročnine formul. To množenje nam bo dalo skupno število atomov za določen element.
Zmanjšanje magnezija
Mg (št3)2 + 2li → mg +2lino3
Ocenjujemo številke atoma za vsak element:
MG: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Kemična enačba je že uravnotežena in ji ni treba uravnotežiti.
Rešene vaje
Preden nadaljujete z uravnoteženjem katere koli enačbe, je treba vedno potrditi, če ni več uravnotežena. Kljub temu nadaljujemo z naslednjo vajo:
Vaja 1
Uravnoteženo ali ne?
Vera2Tudi3 + H2O → vera (OH)3
Imamo tri elemente: železo (vera), vodik in kisik. Predlog v času enačb ravnotežja je začeti šteti atom številke manj obilnega elementa v enačbi; ki se običajno razlikuje od H in O. Tako najprej štejemo atome vere:
Lahko vam služi: metil salicilatVera: 2 - 1
Navodilo 3 (OH)3 Ne pomnožite vere na levi strani. Za H in O imamo:
H: 2 - 3
O: 4 - 3
Vsi elementi so neuravnoteženi.
Nihanje
Pred enakomerno ravnovesje H in O moramo uravnotežiti atome vere: najmanj obilen element, saj skoraj ni 3 vere, za razliko od 5 ur in 7 ali 7 ali 7 ali 7. Nato morate dodati vero na desno:
Vera: 2 - 2
Kaj je enako, če postavite 2 kot stehiometrični koeficient pred vero (OH)3. Enačba bo ostala:
Vera2Tudi3 + H2O → 2FE (OH)3
Vera: 2 - 2
H: 2 - 6
O: 4 - 6
Toda H in O ali še naprej neuravnotežen. A h2Ali prispevati 2 h in nam primanjkuje 4 h. Zato bomo dodali še dva h2Ali za nas tri h2Eno:
Vera2Tudi3 + 3H2O → 2FE (OH)3
In še enkrat ocenimo:
Vera: 2 - 2
H: 6 - 6
O: 6 - 6
Upoštevajte, kako so jih uravnotežili, ko smo nekoč uravnotežili h. Enačba je končno uravnotežena.
Vaja 2
Uravnoteženo ali ne?
Pogl4 + Tudi2 → co2 + H2Tudi
Ocenjujemo število atomov za vse sedanje elemente:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Ogljik je uravnotežen, vendar se ne dogaja z vodikom in kisikom. Enačba je neuravnotežena.
Nihanje
Ker je C uravnotežen, ne želimo spreminjati stehiometričnih koeficientov CH4 ali co2. Vsaj načeloma ne.
Svojo pozornost usmerimo na H in O, zlasti na H. Ker? Ker je videti enačbo lažje uravnotežiti H pred oz. Dodati moramo 2 h v desno in postaviti koeficient 2 pred h2Eno:
Pogl4 + Tudi2 → co2 + 2H2Tudi
C: 1 - 1
H: 4 - 4
O: 2 - 4
C in h sta uravnotežena. Ostali smo 2 ali ostali. Če vsak oz2 prispeva 2 ali bomo dodali a oz2 dodatno, da so 4 ali levi. To je isto kot postaviti koeficient 2 pred o2:
Vam lahko služi: žveplov oksidPogl4 + 22 → co2 + 2H2Tudi
C: 1 - 1
H: 4 - 4
O: 4 - 4
In enačba je končno uravnotežena.
Vaja 3
Uravnoteženo ali ne?
N2 + H2 → NH3
Ocenjujemo za naša dva elementa N in H:
N: 2 - 1
H: 2 - 3
Enačba ni uravnotežena.
Nihanje
Začnemo uravnoteženo n, element, ki se razlikuje od H. Primanjkuje nam pravice in kot vsak NH3 prispeva 1 n, dodati moramo še eno NH3 Imeti 2 n:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
In zdaj nam manjka levica. Če vsak h2 Prispevati 2 h k enačbi, nato pa moramo dodati še dva, tako da sta 6 ur. To je isto kot postavitev stehiometričnega koeficienta 3 pred h2:
N2 + 3H2 → 2nh3
N: 2 - 2
H: 6 - 6
In kemična enačba je končno uravnotežena.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Kemija librettexts. (23. novembra 2020). Kako napisati uravnotežene kemijske enačbe. Okrevano od: kem.Librettexts.org
- Wikipedija. (2020). Kemična enačba. Pridobljeno iz: v.Wikipedija.org
- Načela kemije. (s.F.). Pisanje in uravnoteženje kemijskih enačb. [PDF]. Pridobljeno iz: splet.Ung.Edu
- Phet. (s.F.). Uravnoteženje kemijskih enačb. Okrevano od: Phet.Kolorado.Edu
- Armando Marín b. (s.F.). Splošna kemija: uravnoteženje enačb. [PDF]. Okreval od: depa.Fquim.Ne.mx

