Butanalna struktura, lastnosti, uporabe in tveganja
- 1384
- 252
- Roman Schamberger
On Butanal Je aldehid odprte verige, sestavljen iz štirih ogljikovih atomov in je analogen butanu; To je v resnici druga najbolj oksidirana oblika butanskega ogljikovodika po matirični kislini. Njegova molekularna formula je CHO3Pogl2Pogl2Cho, kjer je -cho skupina formin.
Ta aldehid, eden najlažjih, je sestavljen iz prozorne, vnetljive in manj goste tekočine kot voda. Poleg tega je topna v vodi in mešljiva z večino organskih topil; Zato se lahko uporablja za enofazno organsko mešanico.
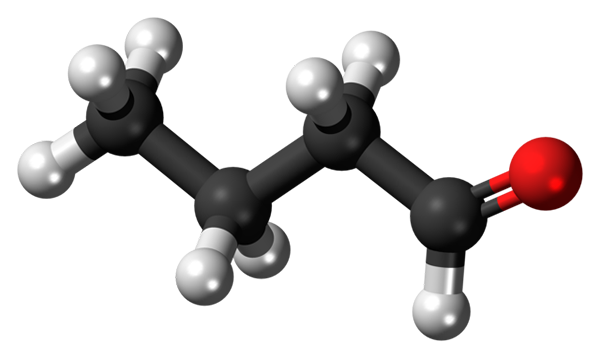
 Butanal ali butiraldehid molekula. Vir: Jynto [CC0]
Butanal ali butiraldehid molekula. Vir: Jynto [CC0] Prisotnost karbonilne skupine (tistega rdeče krogle, vrhunska podoba) daje kemično polarnost butanalni molekuli in s tem sposobnost doživeti interakcijo dipola-dipolo med njegovimi molekulami; Čeprav med njimi ne nastanejo nobeni vodikovi mostovi.
To posledično prinaša, da je butanal prisoten vrel in fuzijske točke, večje od butana, vendar manj kot tiste, ki jih je predstavil N-Boutil alkohol.
Butanal se uporablja kot topilo in je posrednik za pridobivanje številnih izdelkov; kot so pospeševalci vulkanizacije gub, smol, farmacevtskih in agrokemičnih izdelkov.
Butanal je strupena spojina, ki lahko vdihavanje povzroči vnetje zgornjega dihalnega trakta, bronhije in pljučnega edema, ki ima celo usodne posledice.
[TOC]
Butanalna struktura
Pravkar je bilo omenjeno, da je skupina formin, -ch. Kot rezultat tega lahko njihove molekule med seboj medsebojno delujejo prek dipol-dipolovih sil.
Vam lahko služi: rotacijski sušilnik: delovanje, za kaj je, deli, aplikacijeNa zgornji sliki je prikazano z modelom kroglic in palic, da ima butanalna molekula linearno strukturo. Skupinski ogljik -cho ima hibridizacijo SP2, Medtem ko so preostali ogljikovi3.
Ne samo to, ampak je tudi prilagodljivo in njihove povezave se lahko vrtijo na lastnih osi; In tako nastanejo različne konformacije ali konformatorji (ista spojina, vendar z njihovimi zasukanimi povezavami).
Konformeros
Naslednja slika najbolje razloži to točko:
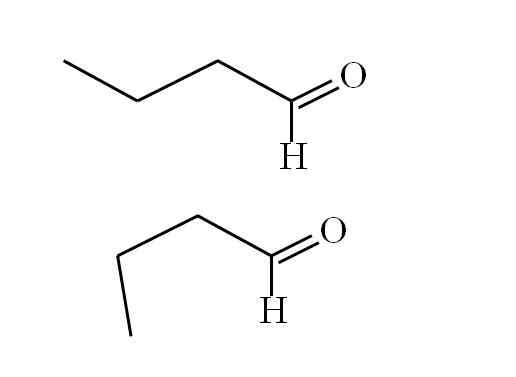 Butanalna skladnost. Vir: Gabriel Bolívar.
Butanalna skladnost. Vir: Gabriel Bolívar. Prvi konformer (nadrejeni) ustreza molekuli prve slike: metilna skupina na levi, -CH3, in skupina -cho sta v proti vzporednih položajih; Eno pokaže in drugo navzdol.
Medtem drugi konformer (spodnji) ustreza molekuli z -CH3 in -ho v zasenčenih položajih; to pomeni, da oba kažeta v isto smer.
Oba konformatorja sta hitro zamenljiva, zato se butanalna molekula vrti in nenehno vibrira; In dodal dejstvo, da ima trajni dipol, to omogoča, da so njegove interakcije dovolj močne, da zavre pri 74,8 ° C.
Lastnosti
Kemična imena
-Butanal
-Butiraldehid
-1-butanal
-Butiral
-N-butiraldehid.
Molekularna formula
C4H8Ali pogl3Pogl2Pogl2Cho.
Fizični videz
Je jasna, prozorna tekočina.
Vonj
Značilen vonj, hektar, aldehid.
Vrelišče
167 ° F pri 760 mmHg (74,8 ° C).
Tališče
-146 ° F (-96,86 ° C).
točka vžiga
-8 ° F (-22 ° C) zaprto steklo.
Topnost vode
7 g/100 ml pri 25 ° C.
Topnost v organskih topilih
Mešljiv z etanolom, etrom, etil acetatom, acetonom, toluenom in številnimi drugimi organskimi topili.
Gostota
0,803 g/cm3 pri 68 ° F.
Vam lahko služi: nitrati: lastnosti, struktura, nomenklatura, usposabljanjeGostota hlapov
2,5 (v zračnem razmerju, enaki 1).
Parni tlak
111 mmHg pri 25 ° C.
Samo-usmeritev
446 ºF. 425 ° F (21,8 ° C).
Goo
0,45 cpoise pri 20 ° C.
Toplota zgorevanja
2479,34 kJ/mol pri 25 ° C.
Toplota za uparjanje
33,68 kJ/mol pri 25 ° C.
Površinska napetost
29,9 Dina/cm A 24 ° C.
Prag vonja
0,009 ppm.
Lomni količnik
1.3843 do 20 ° C.
Dipolarni trenutek
2,72 d.
Valovne dolžine (λ) največje absorpcije v vodi
225 nm in 282 nm (ultravijolična svetloba).
Polimerizacija
Butanal se lahko polimerizira v stiku z alkaliji ali kislino, kar je nevarna polimerizacija.
Reaktivnost
Ko je izpostavljen zraku oksidirano, tvori matsko kislino. Pri temperaturi 230 ° C je butanal spontano vneto z zrakom.
Aldolska kondenzacija
Dve butanalni molekuli se lahko v prisotnosti KOH in temperaturi 6-8 ° C reagirata, da tvorita spojino 2-etil-3-hidroksiheksanol. Ta spojina se imenuje Aldol, saj ima v svoji strukturi aldehidno skupino in alkoholno skupino.
Sinteza
Butanal se lahko pojavi s katalitično dehidrogenacijo N-butilnega alkohola; katalitična hidrogenacija krotonaldehida; in hidroformilacija propilena.
Prijave
Industrijalisti
-Butanal je industrijsko topilo, vendar je tudi posrednik v sintezi drugih topil; Na primer 2-etilheksanol, N-butanol in trimetilpropane.
-Uporablja se tudi kot posrednik pri izdelavi sintetičnih smol, med njimi butiralni polivinil; Pospeševalci vulkanizacije gume; izdelava farmacevtskih izdelkov; izdelki za zaščito pridelkov; pesticidi; antioksidanti; Pomočni pomočniki.
-Butanal se uporablja kot surovina za izdelavo sintetičnih aromov. Poleg tega se uporablja kot sredstvo za aromatizacijo hrane.
Lahko vam služi: natrijev bromid (NABR)Drugi
-V človeku se butanal uporablja kot biomarker, ki kaže na oksidacijsko škodo, ki ga doživljajo lipidi, beljakovine in nukleinske kisline.
-Uporabljali so ga eksperimentalno, skupaj s formalinom in gluterdehidom, da bi poskušali zmanjšati mehčanje, ki ga imajo čelade goveje čelade, zaradi izpostavljenosti vodi, urinu in iztrebku goveda. Eksperimentalni rezultati so bili pozitivni.
Tveganja
Butanal je uničujoč za sluznice tkivne membrane zgornjega dihalnega trakta, pa tudi za tkiva kože in oči.
S stikom s kožo proizvede rdečico in opekline. V očeh nastajajo enake lezije, ki jih spremljajo bolečina in poškodba očesnega tkiva.
Butanalno vdihavanje ima lahko resne posledice, saj lahko proizvede v grlu in vnetju in edemih bronhialov; Medtem ko je v pljučih, proizvaja kemično pljučnico in pljučni edem.
Znaki prekomerne izpostavljenosti obsegajo: ardorski občutki na zgornjem dihalnem traktu, kašelj, piskanje, torej emisija piščalke pri dihanju; laringitis, pomanjkanje diha, glavobol, slabost in tudi bruhanje.
Vdihavanje je lahko usodno kot rezultat krčenja popravilnih cest.
Butanalno zaužitje povzroča občutek "gorenja" na prebavnih poteh: ustna votlina, žreb, požiralnik in želodec.
Reference
- Morrison, r. T. In Boyd, r. N. (1987). Organska kemija. (5ta Izdaja.). Uredništvo Addison-Wesley Iberoamericana.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Pubchem. (2019). Butanal. Okrevano od: pubchem.NCBI.Nim.ameriški nacionalni inštitut za zdravje.GUV
- Wikipedija. (2019). Butanal. Okrevano od: je.Wikipedija.org
- Kemijska knjiga. (2017). Butanal. Obnovi se od: Kemicalbook.com
- Basf. (Maj 2017). N-butiraldehid. [PDF]. Pridobljeno iz: topila.Basf.com
- « Primarne značilnosti ogljika, vrste in primeri
- Integrirane izobraževalne značilnosti in kako to doseči »

