Zgodovina, struktura, lastnosti, uporabe, sinteza, tveganja

- 1990
- 577
- Percy Feeney
On Borax ali natrijev borat To je poimenovanje za skupino kemičnih spojin z osnovno formulo NA2B4Tudi7. Gre za higroskopsko sol, ki lahko tvori številne hidrate, poleg strukturnega obogatitve s prisotnostjo določenih nečistoč kovin.
Glavne spojine, ki se imenujejo borax2B4Tudi7; Pentahidrat natrijev tetrarone (NA2B4Tudi7).5H2Tudi; in natrijev tetrabora2B4Tudi7.10H2Ali ali njen enakovredni, oktahidratni natrijev tetraolate, NA2B4Tudi5(OH)4.8h2Tudi.
 Fragment borax. Vir: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Fragment borax. Vir: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Kot je razvidno, se vse prejšnje trdne snovi razlikujejo le po stopnji hidracije; Nekateri imajo v svojih kristalih več molekul vode kot drugi. Fizično je boraks podoben koščkom ali robustnim kristalom krede (nadrejena slika).
Seveda je borax v sedimentih sezonskih jezer, ki jih posuši z izhlapevanjem. Borax se pojavlja v Turčiji, Searles Lakes (Kalifornija), v puščavi Atacama, Čile, Bolivija, Tibet in Romunija. Sintetično lahko kristale boraksa dobimo s počasnim postopkom nukleacije; to je naklonjena rast kristalov.
Natrij, brezvodni in razpadajoči tetrabora so v hladni vodi malo topni; Toda njegova topnost se poveča s povečanjem temperature. Na2B4Tudi7.10H2Ali pa je zelo topen v etilen glikolu, zmerno topno v etanolu in malo topno v acetonu; To so manj polarna topila kot voda.
Borax ima številne aplikacije, na primer pri izdelavi detergentov in mil; kot zamuda požara celuloznega materiala; v proizvodnji vlaken; pri čiščenju trdih površin, kot so kovine, steklo in keramika; in pri inhibiciji korozije med drugim.
Borax draži za oči, kožo in dihalne trakte. Z zaužitjem lahko med drugimi simptomi povzroči bruhanje, drisko, povezovanje, razpadanje in napade. Trenutno se sumi, da imajo lahko škodljivi učinki na reprodukcijo ljudi.
[TOC]
Zgodovina
Zgodovina Boraxa je zmedena. Poudarjeno je, da so ga odkrili v postelji Tibetskega jezera, posušeno z izhlapevanjem. V sedmem stoletju Tibeta je bil premeščen v Savdsko Arabijo po tako usmerjeni svileni poti.
Izraz "borax" je bil priljubljen po številnih aplikacijah, ki so jih našli in tržili pod imenom 20 Mule Team Borax Tradermax, ki se je nanašala na način, kako se je boraks prevažal skozi puščave Nevade in Kalifornije.
Druga različica njihovega odkritja kaže, da so Egipčani že dolgo vedeli po svojem obstoju, pri čemer so jo uporabljali v zvarah kovin s toploto. Poleg tega so ga uporabljali v medicini in v postopku mumifikacije. Borax je v trinajstem stoletju v Evropo prenesel Marco Polo.
Sredi devetnajstega stoletja so v puščavi Magove odkrili velika boraks.
Struktura boraksa
 Struktura borax ionov. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Struktura borax ionov. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Vrhunska slika prikazuje ione, ki sestavljajo boraks, posebej ustrezajo trdni snovi s kompozicijsko formulo Na2[B4Tudi5(OH)4] · 8h2Ali (ali na2B4Tudi7· 10H2Da).
Najprej je mogoče opaziti konstrukcijo aniona v kletki [B4Tudi5(OH)4]2- (Čeprav bi moral imeti dve skupini-), v katerem je mogoče opaziti osmerokotni obroč (štirje atomi B in štiri O)), z B-O-B mostom, ki ga razdeli na dve polovici.
Vam lahko služi: alkalne rešitve: definicija, lastnosti in uporabeTa kletka ne ostane statična, ampak vibrira in sprejema različne skladbe v prostoru; Vendar v manjši meri v bližini mostu. Opazimo lahko tudi, da je zelo "oksigeniran"; To pomeni, da ima veliko kisikovih atomov, ki so sposobni interakcije z molekulami vode z uporabo vodikovih mostov.
Ni presenetljivo, da lahko kristali boraksa hidrirajo in ustvarijo številne hidrate. Tako za trdno na2[B4Tudi5(OH)4] · 8h2Ali pa je osem H molekul2Ali interakcijo z boraratno kletko in hkrati s kovinskimi središči Na+.
Na kationski strani imate vodni kompleks [Na (H2Da)4]+n, kjer bo vrednost n odvisna od aniona/kationskega deleža. V zgornji trdni snovi, n = 2, torej imate: [na2(H2Da)8]2+, katerih obremenitev 2+ nevtralizira obremenitev 2- boratnega aniona.
Kristali
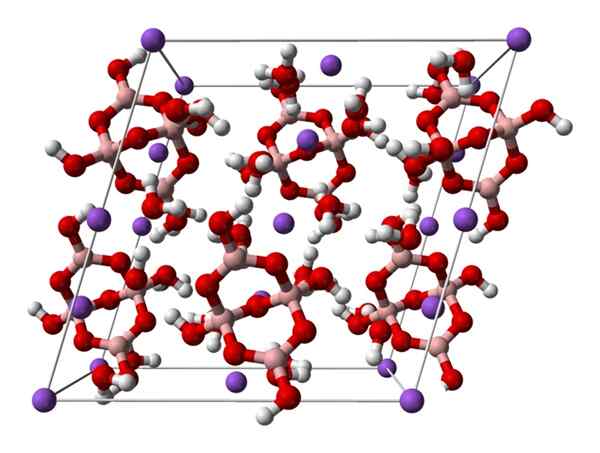 Borax monoklinična celica. Vir: Ben Mills [javnost
Borax monoklinična celica. Vir: Ben Mills [javnostDomena].
Gor2[B4Tudi5(OH)4] · 8h2Ali ali na2B4Tudi7· 10H2Tudi. Tukaj elektrostatične znamenitosti in vodikovi mostovi upravljajo ali prevladujejo v strukturnih vzorcih, ki izvirajo iz vsakega kozarca kozarca.
Drugi hidrati in brezvodna sol izgubijo eno ali vse svoje molekule vode, kar spremeni sestavo in strukturo kristala Borax. V vseh njih anion in kation ostaneta enaka (razen če obstajajo nečistoče ali stranske reakcije), zato zmede ni mogoče ustvariti.
Zmede z anionom Boraato
Na2[B4Tudi5(OH)4] · 8h2Ali in na2B4Tudi7· 10H2Ali so enaki. Ker?
Prvič, če se štejejo njihovi atomi, bodo videli, da sovpadajo po številu; In drugič, v anionu B4Tudi72- Upošteva se odsotnost obeh skupin OH, povezanih z glavami borovih mostov B-O-B; dva oh, to skupaj z dvema h+ od b4Tudi72-, dodajte do 2 h2Ali dajanje skupno 10 ur2O (8 + 2).
Lastnosti
Imena
- Boraks.
- Natrijev borarat.
- Natrijev tetrabora.
- Datacijski tetraolation.
Molekularna masa
Anhidro: 201,22 g/mol.
Decohidrat: 381,38 g/mol.
Fizični videz
Kristalno bela trdna snov.
Gostota
Brezvodna: 2,4 g/cm3
Decahis: 1.739 g/cm3
Tališče
Anhidro: 743 ° C (1.369 ° F, 1.016 K).
Decohidrat: 75 ° C.
Vrelišče
Anhidro: 1.575 ° C (2.867 ° F, 1.848 K).
Topnost vode
31,78 g/l (tako za brezvozni kot za razcvetje).
Topnost v organskih topilih
V etilen glikolu je zelo topen, zmerno topen v dietilen glikolu in metanolu in rahlo topno v acetonu.
Indeks loma (ηD)
Anhidro: η1 = 1,447; η2 = 1.469.
Decayedrado: η2 = 1.472.
Stabilnost
Je stabilen v ustreznih pogojih skladiščenja. Čeprav ima nizko paro tlak, se poveča s temperaturo, kar povzroči kristalizacijo in kondenzacijo, zato se je treba izogibati prekomernim nihanjem temperature in vlage.
Svetlobna emisija
Natrijev tetramounciranje, če je podvrženo dejanju ognja, oddaja zeleno luč.
Reakcije
- Ko se raztapljajo v vodi, alkalne raztopine izvirajo s pH okoli 9.2.
- Borax reagira na druge borate, kot je Perbarat (PBS).
- Prav tako proizvaja borovo kislino, ko reagira s klorovodikovo kislino:
Na2B4Tudi7· 10H2O + hcl => 4 h3BO3 + 2 na+ + 2 Cl- + 5 h2Tudi
- Natrijeva tetralna se obnaša kot amfohetna snov, saj je v vodni raztopini hidroliziran in lahko nevtralizira kislino. Na enak način je sposobna nevtralizirati alkalije z visoko koncentracijo, pri čemer se izogne prekomernemu zvišanju srednjega pH.
Vam lahko služi: primarni alkohol: struktura, lastnosti, nomenklatura, primeriPrijave
Borax ima številne aplikacije, tako v človeku kot v naboru dejavnosti, ki jih izvaja.
Dejanje antioksidantov
Borax ima sposobnost raztopitve oksidov. Zaradi tega se uporablja pri obnavljanju kovin, kot so medenina, baker, svinec in cink.
Uporablja se tudi za preprečevanje oksidacije kovinskih palic v temeljih. Borax pokriva svojo površino, razen zraka, zato se izogne oksidaciji. Poleg tega preprečuje korozijo železovega materiala pri proizvodnji avtomobilov.
Topnost boraksa v etilen glikolu je bila uporabna pri formulacijah proti zbrihu. Boraks nevtralizira kisle odpadke, ki nastanejo med razpadom etilen glikola, kar zmanjšuje oksidacijo, da lahko površina kovin trpi.
Izdelava lepil
- Borax je del formulacije lepilnega škroba za valovit papir in karton.
- Gre za pepptizacijsko sredstvo pri izdelavi lepil, ki temelji na kazeinu in dekstrinu.
- Dejanja, ki krepijo lepilne materiale s prečkanjem konjugiranih skupin hidroksilov.
Ogenj retardant
Uporablja se kot retard za požar v celuloznih materialih in drugih polimerih, ki vsebujejo skupine hidroksilskih skupin. Svoje delovanje izvaja skozi več mehanizmov, vključno z tvorbo steklaste plasti, ki omejuje dostop goriv.
Borosilizirano stekleno izdelavo (Pyrex)
Borax je vir bora, ki se uporablja pri izdelavi borosiliziranega stekla; Za katero je značilna visoka fuzijska točka, nizki koeficient razširitve in visoka odpornost na toplotne udarce.
To vam omogoča, da ste podvrženi visokim temperaturam, ne da bi doživeli zlome in prejemali ognjevzdržno steklo.
Borosilizirano steklo se uporablja pri izdelavi materialov, ki jih je treba uporabljati za peko hrane. Uporablja se tudi v laboratoriju v Beaker, Fixolas, meri jeklenke, pipete itd.
Emulgator
Borax se skupaj z drugimi spojinami uporablja za emulgiranje mil in drugih parafinov. Uporablja se tudi kot osnova za izdelavo losjonov, krem in mazil.
Čistilni material
- V formulacijah se doda za čiščenje trdnih površin, kot so kovine, steklo in keramika.
- Uporablja se v čistilih za roke, polirnem materialu in detergentnih milah v pralnici in domu. Poleg tega olajša odstranitev mastnih nahajališč iz tal tovarn.
Medicinske uporabe
- Uporablja se pri zdravljenju okužb z glivicami.
- Je del formule hranil, ki oskrbuje boro. Ta element naj bi posredoval v presnovi kalcija, fosforja in magnezija, ki je potreben za strukturo kosti.
- Posega pri določanju glikoziliranega hemoglobina (HBA1C), dokaz, ki služi za poznavanje razvoja dolgoročne sladkorne bolezni pri pacientu, saj je polčasnega časa eritrocita 120 dni.
Te informacije so za zdravnika bolj koristne kot osamljene določitve bolnikove glukoze v krvi.
PH amortiber
Uporablja se pri več amorbizerjih pH, ki se uporabljajo v biokemiji; Med njimi TRIS (hidroksimetil) aminometansko boray, ki se uporablja v elektroforezi v poliakrilamidu DNA in RNA nukleinskih kislin.
Zmanjšanje trdote vode
Borax se lahko kombinira s kalcijevimi in magnezijevimi ioni, ki so prisotni v vodi, kar zmanjša njegovo koncentracijo. Na ta način se trdota vode zmanjša.
Vam lahko služi: kalijev hidroksid: struktura, lastnosti, uporabeGnojilo in gnojilo
Borax se uporablja kot vir bora. Kalcij in boron sta vključena v tvorbo celične stene rastlin. Poleg tega je bilo poudarjeno, da boron daje prednost opraševanju, zato posega v oploditev in širjenje rastlin.
Leseno varstvo
Borax se bori proti Woodwoodu, hrošč, ki porabi in uničuje les. Uporablja se tudi pri ohranjanju in vzdrževanju lesenih ladij.
Ustanovitev in pretok
Uporablja se kot ustanovitelj v jeklenem in železnem varjenju, kar povzroči zmanjšanje tališča in izločanje železovega oksida; Neželeno onesnaževalo. S podobnim koncem sodeluje pri varjenju zlata in srebra.
Drugi
- Uporablja se kot mehki pesticid; Na primer za boj moljev v volni.
- Sprayed servis za nadzor škodljivcev, ki so prisotni v omarah, notranjih nahajališčih, v vrzeli sten in na splošno, kjer uporaba več onesnaževanja pesticidov ni zaželena.
- Uporablja se v jedrskih reaktorjih za nadzor reakcij, ki bi lahko v skrajnih primerih nastale verižne reakcije.
- V avtomobilskih radiatorjih se borax uporablja za pridobivanje mest, kjer so pobegi z vodo.
Sinteza
Borax dobimo z react5Tudi9.8h2Ali z natrijevim karbonatom in natrijevim hidrokarbonatom v vodnem mediju.
Pravzaprav se sinteza natrijevega ali borax tetratera uporablja malo; Večina proizvedene spojine dobimo z njegovo ekstrakcijo mineralov, ki vsebujejo.
Postopek je mogoče povzeti v raztopini rude v vodi, čemur sledi glinena filtracija in na koncu izhlapevanje vodne raztopine.
Tveganja
Borax je naravni izdelek, vendar lahko pri ljudeh povzroči vrsto zdravstvene škode. Na primer, zaradi stika s prahom prahu lahko pride do draženja kože, ki lahko povzroči dermatitis.
Prav tako borax povzroči draženje oči in zgornje dihalne trakte. Med simptomi njenega vdihavanja obstajajo bolečine v kašlju in grlu.
Medtem vnos Boraxa predstavlja naslednje simptome: bruhanje, slabost, driska, povezovanje, glavobol in napadi. Poleg tega lahko pride do naklonjenosti centralnega živčnega sistema in delovanja ledvic.
Iz študij, opravljenih pri moških -seks podganah, ki jih hranijo z boraksom, so opazili atrofijo testisov. Medtem ko so študije, opravljene z nosečnicami, podgana.
Verjame se, da lahko izpostavljenost boraksu vpliva na reproduktivno delovanje pri moških, ki se kaže z zmanjšanjem štetja sperme.
Usodni odmerek od 10 do 25 gramov je ocenjen za vnos boraksa pri odraslih.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Nacionalni center za informacije o biotehnologiji. (2019). Argon. Baza podatkov Pubchem. Cid = 23968. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Karolyn Burns, Seneca Joseph in Dr. Ryan Baumbach. (s.F.). Sinteza in lastnosti kristalov boraksa in medmetalnih zlitin. Okreval od: NationalMaglab.org
- Wikipedija. (2019). Boraks. Pridobljeno iz: v.Wikipedija.org
- Rio Tinto. (2019). Boraks dehidrat. 20 Mule Team Borax. Obnovi se od: borax.com
- Fletcher Jenna. (14. januar 2019). Je borax varen za uporabo? Okrevano od: MedicalNewstody.com
- « Struktura kromiranja klorida (CRCL3), lastnosti, uporabe
- Transgene značilnosti hrane, prednosti, primeri, posledice »

