Struktura kromiranja klorida (CRCL3), lastnosti, uporabe

- 2874
- 774
- Stuart Armstrong
On Krom klorid (crcl3) Gre3+ in cl anions- v deležu 1: 3; to je za vsak cr3+ Obstajajo trije CL-. Kot bomo videli pozneje, njihove interakcije niso ionske. Ta sol se lahko pojavi v dveh oblikah: anhidra in heksahidrat.
Za brezvodno obliko je značilno, da predstavlja obarvanost vijolično-rdečega; Medtem ko je heksahidrat, crcl3.6H2Ali pa je temno zelena. Vključitev molekul vode spreminja fizikalne lastnosti teh kristalov; kot njegove vrele in fuzijske točke, gostote itd.
 Vijolični kristali kromiranega klorida (iii) brezvodni. Vir: Ben Mills [javna domena]
Vijolični kristali kromiranega klorida (iii) brezvodni. Vir: Ben Mills [javna domena] Krome klorid (III) (glede na nomenklaturo zalog) se razgradi pri visokih temperaturah in postane krom klorid (II), CRCL2. Jed je za kovine, čeprav se uporablja v Chrome: postopek, v katerem so kovine prekrite s tanko kromirano plastjo.
Cr3+, Prihaja iz ustreznega klorida, se uporablja pri zdravljenju sladkorne bolezni, zlasti pri bolnikih s skupno parenteralno prehrano (TPN), ki ne zaužijejo potrebne količine kroma. Vendar so rezultati veliko boljši (in bolj zanesljivi), če so dobavljeni kot picolinato.
[TOC]
Struktura kromiranja klorida
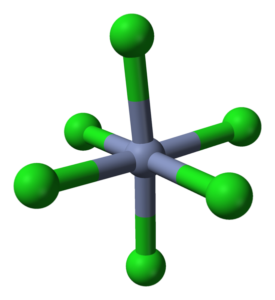 Octaedro koordinacija za CRCL3 v svojih kristalih. Vir: Ben Mills [javna domena]
Octaedro koordinacija za CRCL3 v svojih kristalih. Vir: Ben Mills [javna domena] Crcl3 Kljub temu, da je sol, narava njihovih interakcij ni zgolj ionska; Imajo določen kovalenten značaj, produkt usklajevanja med CR3+ in Cl-, ki povzroča deformiran oktaedron (nadrejena slika). Chrome se nahaja v središču oktaedra, klorovi pa pri svojih točkah.
Oktahedron crcl6 Lahko na prvi pogled nasprotujete formuli CRCL3; Vendar ta popolni oktaedron ne definira enotne celice kozarca, ampak kocka (tudi deformirana), ki na polovico reže zelene sfere ali klorove anione.
Vam lahko služi: 20 primerov kemične sublimacije in značilnostiKristalne plasti brezvodne
Tako enotna celica s tem oktaedro še naprej ohranja delež 1: 3. Če reproduciramo te deformirane kocke v vesolju, dobimo kristal CRCL3, ki je predstavljena na vrhunski sliki s tridimenzionalnim modelom polnjenja in modelom kroglic in palic.
 Kristalna struktura CRCL3, predstavljena s tridimenzionalnimi kroglami in palicami. Vir: Ben Mills [javna domena]
Kristalna struktura CRCL3, predstavljena s tridimenzionalnimi kroglami in palicami. Vir: Ben Mills [javna domena] Ta kristalna plast je ena izmed mnogih, ki jih naredi3 (Ne zamenjujte barve kozarca, resničnega, z barvo zelenih sfer).
Kot je razvidno, Cl Anions- Zasedejo površino, zato njihove negativne obremenitve odbijajo druge kristalne plasti. Posledično kristali postanejo prevare in krhki; Toda briljantno, zaradi kroma.
Če se te iste plasti vizualizirajo z stranske perspektive, bomo namesto oktaedre opazili tetraederje:
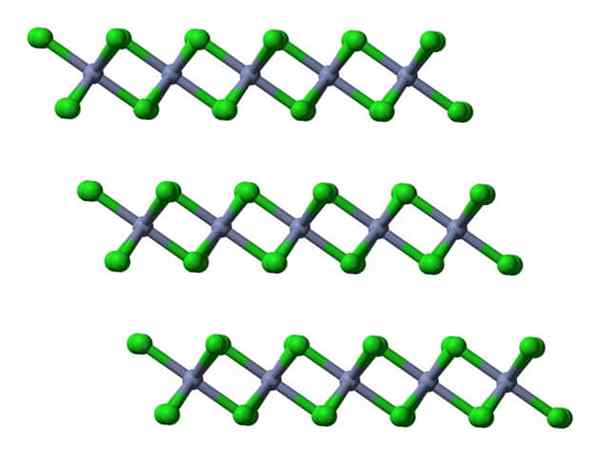 CRCL3 kristalne plasti poglede bočno. Vir: Ben Mills.
CRCL3 kristalne plasti poglede bočno. Vir: Ben Mills. Tu je razumevanje, zakaj se plasti med seboj odbijajo- njegovih površin.
Lastnosti
Imena
-Krom klorid (iii)
-Krom triklorid (iii)
-Krom klorid (iii) brezvoljni.
Kemična formula
-Crcl3 (brezvodna).
-Crcl3.6H2O (šestnajsti).
Molekularna teža
-158,36 g/mol (brezvodni).
-266,43 g/mol (heksahidrat).
Fizični opis
-Trdni in vijolično-serestični kristali (brezvodni).
-Temno zeleni kristalni prah (heksahidrat, spodnja slika). V tem hidratu ga lahko vidimo, ko voda zavira svetlost, kovinsko kromirano lastnost.
 Heksahidrat krom krom. Vir: Uporabnik: Walkerma [javna domena]
Heksahidrat krom krom. Vir: Uporabnik: Walkerma [javna domena] Tališče
-1.152 ° C (2.106 ° F, 1.425 K) (anhid)
-83 ° C (heksahidrat).
Vrelišče
1300 ° C (2.370 ° F, 1.570) (anhid).
Topnost vode
 Vodne raztopine kromiranega klorida (III). Vir: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Vodne raztopine kromiranega klorida (III). Vir: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] -Rahlo topno (anhidro).
-585 g/l (heksahidrat).
Na zgornji sliki je prikazana vrsta epruvetov, napolnjenih z vodno raztopino CRCL3. Upoštevajte, da bolj ko je koncentrirana, bolj intenzivna je barva kompleksa [Cr (OH2)6]3+, Odgovorna zelena barva.
Vam lahko služi: Putrescina: struktura, lastnosti, sinteza, uporabaTopnost v organskih topilih
Topno v etanolu, vendar netopni v etru (brezvodni).
Gostota
-2.87 gr/cm3 (brezvodna).
-2,76 g/cm3 (Heksahidrat).
Temperatura skladišča
Razgradnja
Ko se segreje na razgradnjo, kromsko klorid (III) oddaja strupene hlape spojin, ki vsebujejo klor. Te spojine se sprostijo tudi, ko kromiran klorid (III) pride v stik z močnimi kislinami.
Korozija
Je zelo jedko in lahko napade določena jekla.
Reakcije
Je nezdružljiv z močnimi oksidanti. Močno reagira tudi z litijem in dušikom.
Ko se segreva v prisotnosti vodika, se zmanjša na kromni klorid (II), s tvorbo vodikovega klorida.
2 crcl3 + H2 => 2 crcl2 + 2 HCl
ph
V vodni raztopini in s koncentracijo 0,2 m: 2,4.
Sinteza
Nastajajo kromirani klorid (III) heksahidrat, ki reagira krom hidroksid s klorovodikovo kislino in vodo.
Cr (OH)3 + 3 HCl +3 h2O => crcl3.6H2Tudi
Nato se za pridobitev anhidra soli segreva3.6H2Ali v prisotnosti tionilo klorida, socl2, klorovodikova kislina in toplota:
[Cr (h2Da)6] Cl3 + 6SOCL2 + ∆ → CRCl3 + 12 HCl + 6SO2
Druga možnost je CRCL3 Klorin plin dobimo na mešanici kroma in ogljikovega oksida.
Cr2Tudi3 + 3 C +Cl2 => 2 crcl3 + 3 co
In končno, če je najbolj uporabljena metoda, je ogrevanje svojega oksida s halogenacijskim sredstvom, kot je ogljikov tetraklorid:
Cr2Tudi3 + 3CCl4 + ∆ → 2crcl3 + 3Cocl2
Prijave
Industrijalisti
Kromirani klorid posega v na -na -na -na -na -pripravi kromiranega klorida (II); reagent, ki posega v zmanjšanje alkil halogenidov, in v sintezo halurosov (e) -salquenilo.
Vam lahko služi: natrijev oksalat (NA2C2O4): struktura, lastnosti, uporabe, tveganja-Uporablja se v tehniki Chromed. To je sestavljeno iz odlaganja s pomočjo galvanoplastike, fine plasti kroma na kovinskih predmetih ali drugem materialu z dekorativnim ciljem, s čimer se poveča korozijska odpornost in tudi površinska trdota.
-Uporablja se kot tekstilni mordant, ki služi kot povezava med obarvanim materialom in tkaninami, ki jih je treba barvati. Poleg tega se uporablja kot katalizator za proizvodnjo olefinov in hidroizolacijskih sredstev.
Terapevtiki
Uporaba U USP kromiranega klorida se priporoča pri bolnikih, ki prejmejo samo intravenske rešitve, ki jih dajemo za skupno parenteralno prehrano (TPN). Zato le, kadar ti bolniki ne prejemajo vseh svojih prehranskih zahtev.
Krom (III) je del faktorja tolerance glukoze, aktivator reakcij, ki jih spodbuja insulin. Menijo, da krom (III) aktivira presnovo glukoze, beljakovin in lipidov, kar olajša delovanje insulina pri ljudeh in živalih.
Krom je prisoten v številnih živilih. Toda njegova koncentracija ne presega 2 po obroku, brokoli pa je hrana z največjim prispevkom (11 µg). Poleg tega je črevesna absorpcija kroma nizka, vrednost od 0,4 do 2,5% zaužita količina.
To otežuje vzpostavitev prehrane za oskrbo s kromiranjem. Leta 1989 je Nacionalna akademija znanosti priporočila med 50 in 200 µg/dan kot ustrezen vnos kroma.
Tveganja
Med morebitnimi tveganji porabe te soli kot kromiranega dodatka so:
-Močne bolečine v želodcu.
-Nenormalna krvavitev, ki se lahko razlikujejo od težav do zacelitve rane, rdečih daljših modric ali zatemnitve izdelka fekalnega blata notranje krvavitve.
-Dražitve v prebavnem sistemu, kar povzroča razjede v želodcu ali črevesje.
-Dermatitis
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Krom (iii) klorid. Pridobljeno iz: v.Wikipedija.org
- Krom (iii) klorid [PDF]. Obnovljeno od: alfa.Kem.Umb.Edu
- Pubchem. (2019). Kromijev klorid heksahidrat. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Nacionalni inštitut za zdravje. (21. septembra 2018). Krom: prehranski dodatek. Pridobljeno iz: sdg.Od.ameriški nacionalni inštitut za zdravje.Gov
- Tomlinson Carole a. (2019). Neželeni učinki kroma klorida. Leaf Group Ltd. Okrevano od: Zdravo.com
- « Zakaj je pomembno brati? 10 Prednosti branja
- Zgodovina, struktura, lastnosti, uporabe, sinteza, tveganja »

