Berkelio (BK) struktura, lastnosti, pridobivanje, uporabe

- 697
- 197
- Dexter Koch
On Berkelij Je kemični element, katerega simbol je BK. Pripada razredu aktinidov, saj je njegov osmi član. Vaša atomska številka je 97. Je sintetična kovinska trdna snov. Ta element ne najdemo naravno nad zemeljsko skorjo. V majhnih količinah je prisoten v porabljenih jedrskih gorivah in ima srebrni sijaj.
V okolju so tudi majhne količine zaradi preskusov jedrskega orožja, zaradi resnih nesreč v atomskih energetskih objektih, kot je Černobil, in sproščanje, ki se pojavljajo iz odpadkov iz jedrskih energijskih rastlin.
 Simbol, število in atomska masa elementa Berkelio. Vir: ME/CC by-S (https: // createCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons.
Simbol, število in atomska masa elementa Berkelio. Vir: ME/CC by-S (https: // createCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons. Praktičnega uporabnosti za Berkelio ni bilo mogoče najti, ker se pojavlja v zelo majhnih količinah in dejstvu, da so vsi njegovi izotopi (atomi BK z različnim številom nevtronov v jedru) radioaktivni. Njegova glavna uporaba je bila v znanstvenih študijah.
Čeprav se njihovi izotopi umetno proizvajajo v posebnih laboratorijih in jih obravnava strokovno osebje, je treba škodo, ki jo je treba odpustiti nevarno sevanje.
[TOC]
Nomenklatura
- Berkelio, simbol BK.
- Berkelio-243, BK-243 ali 243BK: Berkelio Izotop z atomsko maso 243.
Odkritje
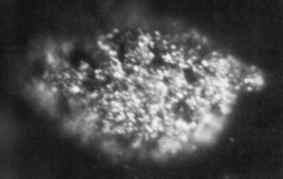 1.7 Mikrofotografski mikrogrami trdnih kovinskih berkelio, pridobljenih leta 1969. Nacionalni laboratorij Oak Ridge, Ministrstvo za energijo / javno domeno ZDA. Vir: Wikimedia Commons.
1.7 Mikrofotografski mikrogrami trdnih kovinskih berkelio, pridobljenih leta 1969. Nacionalni laboratorij Oak Ridge, Ministrstvo za energijo / javno domeno ZDA. Vir: Wikimedia Commons. Prvič ga je leta 1949 izdelal znanstveniki Glen Seaborg, Stanley G. Thompson in Al Ghiorso na univerzi Berkeley v Kaliforniji, ko sta z visokoenergijskimi alfa delci bombardirala Amerike-241 z uporabo ciklotrona (pospeševalnik delcev).
Takoj po obsevanju smo material pravilno raztopili in prešli skozi stolpec z ionsko izmenjavo smole z uporabo raztopine amonijevega citrata kot eluenta.
Na ta način so pridobili izotop številke 97 elementa s 243 atomsko maso, ki oddaja alfa delce in ima pol življenja 4,5 ure.
Ime elementa
Sprva je več raziskovalcev predlagalo, da element prevzame ime enega od njegovih odkritov, Glen Seaborg.
Vam lahko služi: čašaVendar pa uradna organizacija Mednarodna zveza čiste in uporabne kemije ali IUPAC (kratica za angleščino Mednarodna zveza čiste in uporabne kemije) se je odločil, da bo dodelil ime "Berkelio", ker je bilo pridobljeno na univerzi in mestu Berkeley (Kalifornija).
 Nastop območja univerze v Berkeleyju v Kalifniji. Avtor: Sarangib. Vir: Pixabay.
Nastop območja univerze v Berkeleyju v Kalifniji. Avtor: Sarangib. Vir: Pixabay. Ime Berkeley prihaja iz filozofa Angloirlandésa Georgea Barkeleyja, imena, katerega izgovorjava se je nato spremenila v ZDA, ko sta bila leta 1869 mesto in univerza ustanovljena.
To je bilo tisto leto, ko je Dmitri Mendeléjev objavil svojo prvo periodično mizo in začel napovedati obstoj novih elementov, kot je Berkelio.
Elektronska struktura
Njegova elektronska konfiguracija je:
1s2; 2s2 2str6; 3s2 3str6 3d10; 4s2 4str6 4d10 4F14; 5s2 5str6 5d10; 6s2 6str6; 5F9 7s2,
ali kompaktno:
[RN] 5F9 7s2.
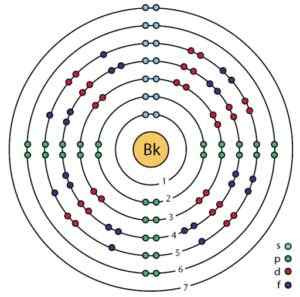 Berkelio elektronska struktura. Orbitale in elektrone je mogoče videti. Ahazard.Sciencewriter/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Berkelio elektronska struktura. Orbitale in elektrone je mogoče videti. Ahazard.Sciencewriter/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Pridobivanje
Prvi vzorec kovine smo pripravili leta 1969 z reakcijo redukcije fluorida (BKF3) Z litijevo kovino (LI) pri temperaturi 1300 K.
Za pripravo tankih kovinskih listov se BKO oksid zmanjša2 S Torio (Th) ali kovinskim lantano.
Berkeliove fizikalne lastnosti
Fizično stanje
Sprane kovinske trdne snovi.
Berkelio kovina ima dve kristalni obliki: alfa (dvojno kompaktno šesterokotnico) in beta (kubično osredotočeno na obraze).
Atomska masa
247
Tališče
1050 ° C (alfa oblika)
986 ° C (beta oblika)
Vrelišče
2627 ° C
Gostota
14,78 g/cm3 (alfa obrazec)
13,25 g/cm3 (beta obrazec)
Paramagnetizem
Po nekaterih virih nekatere spojine Berkelio kažejo paramagnetne lastnosti, kar pomeni, da jih privlačijo magnetna polja.
Ta značilnost je paramagnetnega tipa, ker pri suspendiranju magnetnega delovanja materiala ne ohrani takšnih lastnosti samo.
Kemične lastnosti
Pri visokih temperaturah se kovinski berkelio hitro oksidira v zraku ali kisiku, kar tvori njegove okside. V mineralnih kislinah je zlahka topna, sprošča vodikov plin h2 in oblikovanje bk ionov3+.
Vam lahko služi: aluminijski hidrid (ALH3): struktura, lastnosti, uporabeStanja oksidacije
Začetne preiskave tega elementa so bile omejene na ionske izmenjave in soprecipitacijske poskuse, s katerimi je bilo opaziti, da je stanje oksidacije +3 stabilno in je +4 dostopno v vodni raztopini, saj je BK3+ Lahko oksidira bromato ion (bratec4-) Dati BK4+.
BK stabilizacija4+
V letu 2017 so poročali o stabilizaciji BK4+ V raztopini z uporabo spojine, ki jo tvorijo hidroksipiridinonske skupine, združene s poliaminsko strukturo (imenovano ligand 3,4,3-li (1,2-Hop)).
Ta spojina ima osem mest, kjer se pridruži ion, ki ustrezajo kisikovim atomom skupin C = O in N-OH, pri čemer zapustijo BK4+ trdno povezan z ligand, ostal stabilen.
Trdne spojine
BK4+ lahko soprecipitacijo s Cerio (CE4+) ali cirkonija (zr4+) v fosfatu ali Yodatu. Izvleči ga lahko tudi v bis heksanskih raztopinah (2-etilheksil) hidrogenofosfat ali drugi podobni namestitveni sredstvo.
Prva spojina Berkelio, ki se je pojavila v vidnih količinah, je bil klorid (BKCL3), od koder je bilo leta 1962 pridobljenih 0,000000003 gramov. Od takrat se je več spojin Berkelio lahko pripravilo in preučevalo.
Omenimo jih lahko na primer fosfat (BKPO4), oksiklorid (BKOCL), fluoridi (BKF3 in bkf4), Dioksid (BKO2), trioksid (BK2Tudi3), Yodatos (bk (io3)3 in bk (io3)4),, Klorohidrat [bkcl2(H2Da)6] Cl, oksalat, organometalne spojine in koordinacijske spojine, med drugim.
Novo stanje oksidacije +5
Leta 2018 je skupini preiskovalcev iz več držav uspelo izdelati nitratni kompleks s Pentavalentnim Berkeliom (BK5+) katere formula je BKO2(Ne3)2-, z odpravo dveh molekul2 BK iona (št3)4-, (Bk3+).
Računalniški izračuni energije so potrdili, da je stanje oksidacije +5 tisto, ki ima največjo stabilnost v tem kompleksu Berkenilo nitrata, zato najverjetneje.
Izotopi
Iz Berkelia je bilo od 238 do 251 sintetiziranih 14 izotopov z atomskimi masami. Vsi so radioaktivni.
Lahko vam služi: Benchilo: benzil vodiki, karbokacije, benzil radikaliNajbolj stabilen je Berkelio-247, katerega razpolovni čas je 1380 let. Vsak atom tega izotopa, ko razpadanje oddaja alfa delček in tvori atom Amerike-243.
BK-249 ima razpolovno dobo 330 dni, trpi beta razpadanje in postane Kalifornio-249.
Prijave
Ker jim je uspelo le pridobiti zelo majhne količine tega elementa, je uporabil le v osnovnih znanstvenih raziskavah.
Pri pridobivanju težjih elementov
Isotop BK-249 ima razmeroma dolgo razpolovno dobo in je mogoče.
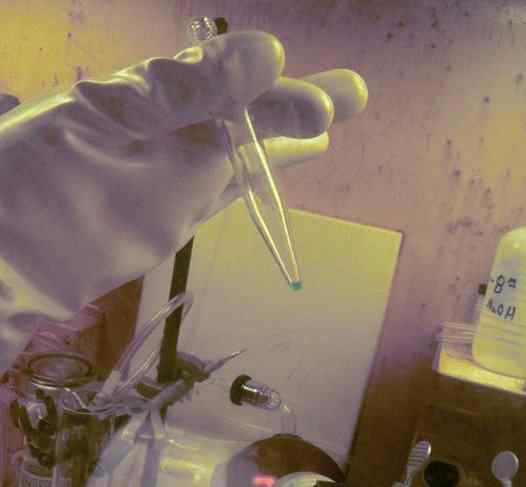 BK mikrokanta, raztopljena v epruveti. Za njegovo pridobivanje je bilo porabljenih 250 dni. Opazimo rokavico za zaščito pred radioaktivnostjo. Ornl, Ministrstvo za energijo / javno domeno. Vir: Wikimedia Commons.
BK mikrokanta, raztopljena v epruveti. Za njegovo pridobivanje je bilo porabljenih 250 dni. Opazimo rokavico za zaščito pred radioaktivnostjo. Ornl, Ministrstvo za energijo / javno domeno. Vir: Wikimedia Commons. V fizikalno -kemijskih študijah
Raziskava, izvedena z BK, omogoča natančnejše ekstrapolacije o lastnostih in obnašanju drugih elementov, ki sledijo v igralski seriji, saj je najtežje elemente težje pridobiti, imajo zelo kratko povprečno življenje in so veliko bolj radioaktivne.
Tveganja
Berkelio je radioaktivni element. Sproščanje radioaktivnosti v okolju lahko doseže vse vrste živali in rastlin, kar jim povzroča škodo. Poslabšanje se lahko nabere v zaporednih generacijah.
 Rastline jedrske energije so radioaktivne in zato zelo nevarne. Avtor: AR130405. Vir: Pixabay.
Rastline jedrske energije so radioaktivne in zato zelo nevarne. Avtor: AR130405. Vir: Pixabay. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Berkelium - BK (element). Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Bela, f.D. et al. (2019). Sodobna kemija Berkelija in Kalifornije. Kemija 2019 6. avgust; 25 (44): 10251-10261. Obnovljen od PubMeda.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Kelley, m.Str. et al. (2018). Kovalen in oksidacijsko stanje aktinida, ki je zapleteno s terapevtskim kelacijskim sredstvom 3,4,3-li (1,2-hopo). Inorg. Kem. 2018 7. maj; 57 (9): 5352-5363. Obnovljen od PubMeda.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kovács, a. et al. (2018). Pentavalentni kurium, berkelij in Kalifornium v nitratnem kompleksu: razširitev aktinidne kemije in oksidacijske stanja. Kem. 2018 6. avgust; 57 (15): 9453-9467. Obnovljen od PubMeda.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Orlova, a.Yo. (2007). Kemija in strukturna kemija brezvodni tritotravalentni aktinidni ortofosferi. V strukturni kemiji anorganskih aktinidnih spojin. Okrevano od Scientirect.com.
- Choppin, g. et al. (2013). Elementi aktinida in transaktinida. V radiokemiji in jedrski kemiji (četrta izdaja). Okrevano od Scientirect.com.
- Peterson, j.R. in Hobart, D.In. (1984). Kemija berkelija. Advances anorganska kemija, letnik 28, 1984, strani 29–72. Okrevano od Scientirect.com.
- Royal Society of Chemistry. (2020). Berkelij. RSC je bil obnovljen.org.

