Antraceno, kaj je, struktura, lastnosti, uporablja
- 4515
- 905
- Barry Ernser
On Antracena To je policiklični aromatični ogljikovodik (PAH), ki ga tvori fuzija treh benzenskih obročev. Je brezbarvna spojina, vendar pod obsevanjem ultravijolične svetlobe pridobi fluorescentno modro barvo. Antracen zlahka sublimira.
Je bela trdna trdna. Trden antracen je v vodi praktično netopen in je delno topen v organskih topilih, zlasti v ogljikovem disulfidu, CS2.
Leta 1832 sta ga odkrila August Laurent in Jean Dumas, pri čemer sta katrana uporabljala kot surovino. Ta material se še naprej uporablja pri proizvodnji antracena, saj vsebuje 1,5 % aromatične spojine. Lahko ga sintetiziramo tudi iz benzokinona.
Najdemo ga v okolju kot produkt delnega zgorevanja fosilnih ogljikovodikov. Najdemo ga v pitni vodi, v atmosferskem zraku, v pobegi motornih vozil in v dimu cigaret. Se pojavlja na seznamu EPA (Agencija za varstvo okolja Združenih držav) najpomembnejših okoljskih onesnaževal.
Struktura antracena
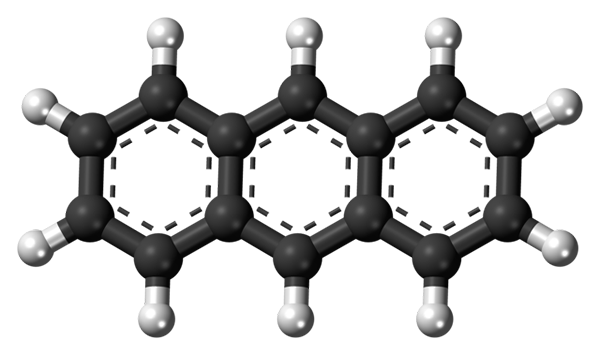 Trije aromatični obroči antracena. Vir: Jynto [CC0]
Trije aromatični obroči antracena. Vir: Jynto [CC0] Zgornja slika prikazuje strukturo antracena, prikazane z modelom sfer in palic. Kot je razvidno, obstajajo trije aromatični obroči šest ogljika; To so benzenski obroči. Pikčaste črte kažejo na aromatičnost, ki je prisotna v strukturi.
Vsi ogljikovi hibridizaciji imajo hibridizacijo2, Torej je molekula v isti ravnini. Zato lahko antracen obravnavamo kot majhen in aromatičen list.
Upoštevajte, da se vodikovi atomi (bele kroglice) praktično odkrijejo pred nizom kemijskih reakcij.
Medmolekularne sile in kristalna struktura
Antracen. Na primer, vidite, da se dva od teh "listov" pridružita in premikata elektrone svojega π oblaka (aromatična središča obročev), uspeta se držati skupaj.
Druga možna interakcija je, da vodiki z določeno pozitivno delno obremenitvijo privlačijo negativna in aromatična središča sosednjih molekul. In zato te znamenitosti izvajajo usmerjeni učinek, ki vodi molekule antracena v vesolju.
Vam lahko služi: konstantna hitrostTako se antracena uredi tako, da sprejme vzorec strukture z dolgim območjem; In zato se lahko kristalizira v monokliničnem sistemu.
Verjetno imajo ti kristali rumenkasto barvni produkt njihove oksidacije do antrakinone; ki izhaja iz antracena, katere trdna snov je rumena.
Lastnosti
Kemična imena
-Antracena
-Paranaftalen
-Antracin
-Zeleno olje
Molekularna formula
C14H10 ali (c6H4CH)2.
Molekularna teža
178.234 g/mol.
Fizični opis
Bela ali bledo rumena trdna. Monoklinski kristali produkt rekristalizacije v alkoholu.
Barva
Ko je čista, je antracena brezbarvna. Z rumeno svetlobo rumeno kristali dajejo fluorescenco modre barve. Predstavite lahko tudi določene rumenkaste tone.
Vonj
Mehko aromatično.
Vrelišče
341.3 ° C.
Tališče
216 ° C.
točka vžiga
250 ° F (121 ° C), zaprta skodelica.
Topnost vode
Praktično netopna v vodi.
0.022 mg/l vode pri 0 ° C
0044 mg/l vode pri 25 ° C.
Topnost etanola
0,76 g/kg pri 16 ° C
3,28 g/kg pri 25 ° C. Upoštevajte, kako je bolj topno v etanolu kot v vodi pri isti temperaturi.
Topnost v heksanu
3,7 g/kg.
Topnost v benzenu
16,3 g/l. Njegova največja topnost v benzenu mu kaže visoko naklonjenost do njega, saj sta obe snovi aromatični in ciklični.
Topnost ogljikovega disulfida
32,25 g/l.
Gostota
1,24 g/cm3 pri 68 ° F (1,25 g/cm3 pri 23 ° C).
Gostota pare
6,15 (z zrakom, ki je vzet kot referenca, enaka 1).
Parni tlak
1 mmHg pri 293 ° F (sublima). 6,56 x 10-6 mmhg pri 25 ° C.
Stabilnost
Je stabilen, če je shranjen pod priporočenimi pogoji. Je triboluminiscentna in triboelektrična; To pomeni, da oddaja svetlobo in elektriko, ko se drgne. Antracen se zatemni, ko je izpostavljen sončni svetlobi.
Samo-usmeritev
1.004 ° F (540 ° C).
Razgradnja
Proizvedejo nevarne spojine z zgorevanjem (ogljikovi oksidi). Razpade, ko se segreje pod vplivom močnih oksidantov, kar proizvaja hektar in strupeni dim.
Lahko vam služi: nitrobenzen (C6H5N2): struktura, lastnosti, uporabe, tveganjaToplota zgorevanja
40,110 kJ/kg.
Kalorična zmogljivost
210,5 j/mol · k.
Največja absorpcijska valovna dolžina (vidna svetloba in ultravijolična)
Največji λ 345,6 nm in 363,2 nm.
Goo
-0,602 cpoise (240 ° C)
-0,498 cpoise (270 ° C)
-0,429 cpoise (300 ° C)
Kot je razvidno, se njegova viskoznost znižuje, ko se temperatura zvišuje.
Nomenklatura
Antracen je enakomerna policiklična molekula, po nomenklaturi, ki je bila ustanovljena za to vrsto sistema, pa mora biti njegovo pravo ime Tricen. Tri predpona je posledica dejstva, da obstajajo trije beancenični obroči. Vendar se je trivialno ime antracena razširilo in zakoreninilo v priljubljeni in znanstveni kulturi.
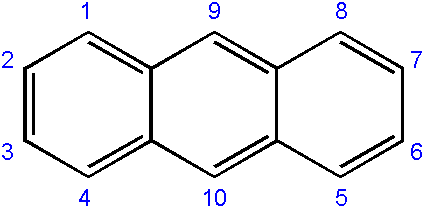
Nomenklatura spojin, pridobljenih iz njega, je običajno nekoliko zapletena in je odvisna od ogljika, kjer se pojavi zamenjava. Naslednje prikazuje ustrezno oštevilčenje ogljikov za antakt:
 Oštevilčenje ogljikov v antraceni. Vir: EDGAR181 [javna domena]
Oštevilčenje ogljikov v antraceni. Vir: EDGAR181 [javna domena] Vrstni red oštevilčenja je posledica prednostne naloge reaktivnosti ali dovzetnosti za omenjene ogljikove.
Ogljikovi konci (1-4 in 8-5) so najbolj reaktivni, medtem ko tisti na sredini (9-10) reagirajo skozi druge pogoje; Na primer oksidativno, da tvori antrakinon (9, 10-dioksontracen).
Strupenost
V stiku s kožo lahko povzroči draženje, srbenje in gorenje, kar se poslabša s sončno svetlobo. Antracen je fotosenzibilizator, ki poveča poškodbe kože, ki jo povzroči UV sevanje. Lahko povzroči akutni dermatitis, teangiektazijo in alergijo.
V stiku z očmi lahko povzroči draženje in gori. Dihanje antracena lahko draži nos, grlo in pljuča, kar povzroči kašelj in piskanje.
Vnos antracena je pri ljudeh povezan z glavobolom, slabostjo, izgubo apetita, vnetjem prebavil, počasne reakcije in šibkosti.
Obstajajo predlogi za delovanje antracena zaradi raka. Vendar ta domneva ni bila podkrepljena, vključno z nekaterimi antraknskimi derivati so bili uporabljeni pri zdravljenju nekaterih vrst raka.
Prijave
Tehnološko
-Antracen je organski polprevodnik, ki se uporablja kot vreteno v visokoenergijskih fotonih, elektronih in alfa delcih.
-Uporablja se tudi za plastično prevleko, kot je PolyViniltoluene. To, da bi ustvarili plastične vretena, z vodo, podobnimi vodami, jo uporabite v dozimetriji radioterapije.
Lahko vam služi: piperidin: struktura, sinteza, derivati, reakcije-Antracen se običajno uporablja kot UV -sevalni grater, ki se nanese v prevleke v tiskanih vezjih. To omogoča pregled podloge z ultravijolično svetlobo.
Samostojna molekula
Leta 2005 so kemiki kalifornijske univerze v Riversideju sintetizirali prvo standardno molekulo: 9.10-ditioantraton. To se potisne v ravno črto, ko se segreje na ravni bakreni površini in se lahko premika, kot da ima dva noge.
Raziskovalci so menili, da je molekula potencialno uporabna pri molekularnem računalništvu.
Piezokromatičnost
Nekateri antracenski derivati imajo piezohromatske lastnosti, to je, da lahko spremenijo barvo, odvisno od pritiska, ki se uporablja. Zato se lahko uporabljajo kot detektorji tlaka.
Antracena se uporablja tudi pri izdelavi tako zaokroženih zaslonov dima.
Ekološko
Politični aromatični ogljikovodiki (PAH) so onesnaževala okolja, predvsem iz vode, zato si prizadevajo za zmanjšanje strupene prisotnosti teh spojin.
Antracen je material (PAH) in se uporablja kot model za preučevanje uporabe metode vodne pirolize pri razgradnji spojin PAH.
Vodna piroliza se uporablja pri industrijski čistitvi. Njegovo delovanje na antraceni je povzročilo tvorbo oksidacijskih spojin: Antrron.
Ti izdelki so manj stabilni od antracena, zato so v okolju manj obstojni, saj jih je mogoče lažje izločiti kot spojine PAH.
Drugi
-Antracen oksidira, da izvira antrokinon, ki se uporablja v sintezi barvil in barvil
-Antracena se uporablja pri zaščito lesa. Uporablja se tudi kot insekticid, možganska kap, herbicid in raticide.
-Antraciklinski antibiotik je bil uporabljen pri kemoterapiji, saj zavira sintezo DNK in RNA. Molekula antraciklina je prepletena med bazami DNA/RNA, kar zavira razmnoževanje hitro rastočih rakavih celic.
Reference
- Antracena. Pridobljeno iz: v.Wikipedija.org
- Antracena. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

