Zgodovina, struktura, lastnosti, uporabe in tveganja

- 2387
- 102
- Ms. Pablo Lebsack
On antimona Je sijoč, srebrni metaloid in z določenim modrim odtenkom. Za njegovo trdno snov je značilen tudi za to, da je zelo krhka in skvamozna tekstura. Spada v skupino 15 periodične tabele, na čelu z dušikom. Po bizmutu (in Moscowiju) je najtežji element skupine.
Predstavljen je s kemičnim simbolom SB. V naravi ga najdemo predvsem v mineralih stabit in ullmannite, katerih kemične formule so SB2S3 in NISBS. Njegova velika nagnjenost k tvorbi sulfidov namesto oksidov je, ker je kemično mehka.
 Kristalni antimon. Vir: Najboljši sci-fatcs [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Kristalni antimon. Vir: Najboljši sci-fatcs [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Po drugi strani je antimona tudi fizično mehka, saj predstavlja trdoto 3 na lestvici MOHS. Je stabilen pri sobni temperaturi in ne reagira z zračnim kisikom. Ko pa se segreje v prisotnosti kisika, tvori antimon trioksid, SB2Tudi3.
Prav tako je odporen na delovanje šibkih kislin; Toda vroče napadejo dušikove in klorovodikove kisline.
Antimona ima številne aplikacije, med njimi se uporabljajo v zlitinah s svincem in kositrom pri izdelavi baterij za vozila, materialov z nizkim trenjem itd.
Ta metalloid ima redko, da se pri strjevanju poveča volumen, kar omogoča, da njenim zlitinam v celoti zasedejo prostor, ki se uporablja za oblikovanje instrumenta, ki je za izdelavo.
[TOC]
Zgodovina vašega odkritja
Pr
Obstajajo dokazi, da od 3100 do.C, antimon sulfid je bil uporabljen kot kozmetika v Egiptu. V Mezopotamiji, trenutni Iraku, ostanki vaze in drugega artefakta so ugotovili, da domnevno datum med 3000 in 2200 leti.C, v katerem je bil uporabljen v svoji antimontaciji.
Uvedba izraza
Roman Erúdito Plinio El Viejo (23-79 D.c) je opisal uporabo antimona, ki ga je poimenoval Estibio, v izdelavi sedmih zdravil v svoji naravni pogodbi. Alkimist Abu Mussa Jahir Ibn Hayyan (721-815) je pripisan uvedbi izraza antimona, da imenuje element.
Uporabil je naslednjo etimologijo: 'anti' kot sinonim za zanikanje in 'mono' samo za. Potem je želel poudariti, da antimona ni sam v naravi. Že je znano, da je del žveplovih mineralov, ki kot drugi elementi.
Pridobivanje
Verjame se, da grško naturist Pedanius Diascorides pridobi čiste antimone z ogrevanjem antimona sulfida v zračnem toku. Italijanski metalurški Vannocio Biringucio v knjigi pirotehnike (1540) opisuje metodo za izolacijo antimona.
Nemški kemik Andreas Libavius (1615) je z uporabo litine mešanice železa, antimona sulfida, soli in kalijevega tartrata dosegel proizvodnjo kristalnega antimona.
Prvo podrobno poročilo o antimonu je leta 1707 podal francoski kemik Nicolas Lemery (1645-1715) v svoji knjigi, obravnavani na antimonu.
Vam lahko služi: bakreni klorid (i) (cucl): struktura, lastnosti, uporabeStruktura antimona
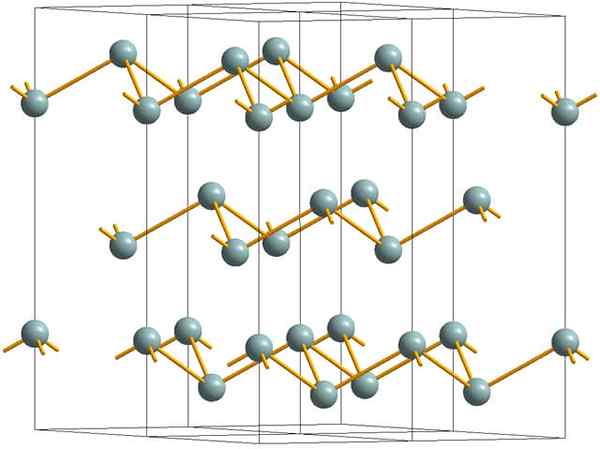 Nagubane plasti, ki sestavljajo kristalno strukturo kovinskega ali srebrnega antimona. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Nagubane plasti, ki sestavljajo kristalno strukturo kovinskega ali srebrnega antimona. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Zgornja slika prikazuje strukturo nagubanih plasti, ki so jih sprejeli arzenski atomi. Vendar sivkast antimon, bolj znan kot kovinski antimon, sprejema tudi to strukturo. Govori se, da je "naguban", ker obstajajo atomi SB, ki se dvigajo in padajo z ravnine, sestavljene iz plasti.
Te plasti, čeprav so odgovorni za fotone, ki z njim delujejo, da zasijejo srebrne bleščice, zaradi česar so antimon kot kovina, resnica je, da so sile, ki jih združujejo, šibke; Od tu do navideznih kovinskih fragmentov SB je mogoče enostavno prikazati in so krhki ali superge.
Poleg tega Atomi SB v nagubanih plasteh niso dovolj, da bi združili svoje atomske orbitale in tako ustvarili pas, ki omogoča električno prevodnost.
Če vidite sivkasto kroglo posamično, lahko vidite, da ima tri povezave SB-SB. Iz višje ravnine je bilo SB mogoče videti v središču trikotnika, s tremi SB pa na njegovih točkah. Vendar trikotnik ni raven in ima dve ravni ali tla.
Lateralna reprodukcija takšnih trikotnikov in njihovih povezav vzpostavlja nagubane plasti, ki so poravnane, da tvorijo kristale Rhomboébic.
Alotropija
Na novo opisana struktura ustreza sivkasti antimoni, najbolj stabilnim od štirih alotropov. Ostali trije alotropi (črno, rumeno in eksplozivno) so metastabilni; to pomeni, da lahko obstajajo v zelo strogih pogojih.
V zvezi z njenimi strukturami ni preveč informacij. Vendar je znano, da je črna antimona amorfna, tako da je njegova struktura zmedena in zapletena.
Rumena antimona je stabilna pod -90 ° C, obnaša se kot ne -metalni element in ga je mogoče domnevati, da je sestavljen iz majhnih aglomeratov SB4 (podobno kot fosfor); Ko se segreje, se spremeni v črni alotrop.
In glede na eksplozivno antimono je sestavljen iz želatinastega rezervoarja, ki nastane na katodi med elektrolizo vodne raztopine antimona halogenida.
Do najmanjšega močnega drgnjenja.
Lastnosti
Atomska teža
121,76 g/mol.
Atomska številka
51.
Elektronska konfiguracija
[KR] 4d105s25 str3.
Stanja oksidacije
-3, -2, -1, +1, +2, +3, +4, +5.
Fizični opis
Bujno srebro, krhka, ploščata površina, z modrim odtenkom. Lahko se pojavi tudi kot črni prah.
Tališče
630,63 ° C.
Vrelišče
1.635 ° C.
Gostota
-6.697 g/cm3 pri sobni temperaturi.
-6,53 g/cm3 V tekočem stanju je temperatura enaka ali večji do tališča.
Fuzijska toplota
19,79 kJ/mol.
Toplota za uparjanje
193,43 kJ/mol.
Vam lahko služi: bakreni sulfid: struktura, lastnosti, uporabeMolarna kalorična sposobnost
25,23 j/mol.K
Elektronegativnost
2.05 (Pauling Scale).
Atomski radio
140 popoldne.
Trdota
To je mehki element, s trdoto 3 na lestvici MOHS in ga lahko opraskate s steklom.
Stabilnost
Je stabilen pri sobni temperaturi, ne doživlja oksidacije. Je tudi odporen na napad kisline.
Izotopi
Ima dva stabilna izotopa: 121Sb in 123Sb. Poleg tega obstaja 35 radioaktivnih izotopov. Radioaktivni izotop 125SB je tisti z največjo polovico: 2,75 let. Na splošno radioaktivni izotopi oddajajo β sevanje+ in β-.
Električna in toplotna prevodnost
Antimona je slab prevodnik toplote in električne energije.
Kemična reaktivnost
Ne more izpodrivati vodika iz razredčenih kislin. Ionska kompleksna oblika z organskimi in anorganskimi kislinami. Kovinski antimon ne reagira z zrakom, ampak se hitro pretvori v oksid v moker zrak.
Halogeni in sulfidi zlahka oksidirajo antimono, če se postopek pojavi pri visokih temperaturah.
Prijave
Zlitine
Antimona se uporablja v zlitini z vodstvom za izdelavo plošč za avtomobilske baterije, izboljšanje odpornosti plošč, pa tudi značilnosti obremenitev.
Svinčena in kositrna zlitina je bila uporabljena za izboljšanje značilnosti zvarov, pa tudi pri sledenju nabojev in kartuš. Uporablja se tudi v zlitinah za električno kabelsko prevleko.
Antimona se uporablja pri zlitinah antifrikcije, pri pripravi lupine in otrdilnih zlitin z nizko vsebnostjo kositra v proizvodnji organov in drugih glasbenih instrumentov.
Predstavlja značilnost, ki jo deli z vodo, povečuje volumen, ko se kondenzira; Torej antimona, ki je prisotna v zlitinah s svincem in kositerjem, zapolni vse prostore kalupov in izboljša definicijo struktur, narejenih s temi zlitinami.
Ogenj retardant
Antimonski trioksid se uporablja za izdelavo igniphed spojin, vedno v kombinaciji s halogeniranimi zaostalimi požari, bromurosom in kloridom.
Požarni zaostali lahko reagirajo s kisikom in radikalnimi atomi OH, ki zavira ogenj. Ti igniphed se uporabljajo v oblačilih za otroke, igrače, letala in na avtomobilskih sedežih.
Dodani so tudi v poliestrskih smolah in v steklenih vlakninah za rabljene predmete, kot so lahki letalski motorji.
Antimonske spojine, ki se uporabljajo kot zaostali za požar, vključujejo: antimon oksiklorid, SBOCL; antimon pentoksid, SBO5; Antimon triklorid, sbcl3; in antimon trioksid, SBO3.
Polje elektronike
Uporablja se pri proizvodnji polprevodnikov, diod, srednjih infrardečih detektorjev in pri izdelavi tranzitorjev. Antimona z visoko čistostjo, ki se uporablja v polprevodniški tehnologiji, dobimo z zmanjšanjem antimonovih spojin z vodikom.
Vam lahko služi: dejavniki, ki vplivajo na topnostZdravila in veterinar
Antimonske spojine se v medicini uporabljajo že od antičnih časov, kot sta Eméticas in Antiprotozoa. Kalijev kalijev tartrato (estetski tartar) je bil dolgo časa uporabljen kot antisquizosomski; Uporablja se tudi kot izkašljeva, diaforetska in Emético.
V kondicioniranju kože prežvekovalnih živali so bile uporabljene tudi antimonske soli; kot so aniomalin ter litij in antimon tiomalat.
Megluminski antimon je zdravilo, ki se uporablja pri zdravljenju leishmaniaze v zunanjih središčih domačih živali. Čeprav je bilo terapevtskih koristi malo.
Pigmenti in slike
Antimonske spojine se uporabljajo pri izdelavi barv in neprozornosti v emajlih. Uporabljajo se tudi v Bermellón, rumenih in oranžnih pigmentih, ki so proizvodi počasne oksidacije antimonskih sulfidov.
Nekatere njegove organske soli (Tartratos) se uporabljajo v tekstilni industriji za pomoč pri povezavi nekaterih barvil.
Antimonski sulfid je bil uporabljen v starodavnem Egiptu kot kozmetični pri temnenju oči.
Druge uporabe
Nekatere antimonske soli se uporabljajo kot nanapeta za odstranjevanje mikroskopskih mehurčkov, ki so nastali na televizijskih zaslonih. Antimonski ioni delujejo s kisikom in odpravljajo svojo težnjo po nastanitvi mehurčkov.
Antimon sulfid (III) se uporablja v glavah nekaterih varnostnih tekem. Antimon sulfid se uporablja tudi pri stabilizaciji koeficienta trenja materialov, ki se uporabljajo v avtomobilskih zavornih ploščicah.
Izotop 124SB se skupaj z berilijem uporablja kot vir nevtronov, s povprečjem energije 24 keV. Poleg tega se antimona uporablja kot katalizator v proizvodnji plastike.
Tveganja
To je krhki element, tako da lahko med manipulacijo pride do onesnaževalskega prahu. Pri delavcih, ki so bili izpostavljeni antimon prahu, so opazili dermatitis, renitis, vnetje visokega dihalnega trakta in konjunktivitis.
Opisana je pnevmokonioza, včasih v kombinaciji z obstruktivnimi pljučnimi spremembami, po dolgotrajnih razstavah.
Antimonski trioksid lahko povzroči poškodbe srčnega delovanja, ki je lahko smrtna.
Pri ljudeh, ki so bili izpostavljeni temu elementu, so opazili prisotnost pustularnih kožnih okužb, prehodne narave.
Nenehni nizki odmerek te kovine lahko povzroči bruhanje driske in razjede v želodcu. Tudi največja dopustna koncentracija v zraku je 0,5 mg/m3.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Manny. (11. marec 2009). Rumena antimona in eksploziven antimon. Pridobljeno od: antimonProperties.Blogspot.com
- Prof. Ernst Cohen in J. C. Van Den Bosch. (1914). Alotropija antimona. Postopki Royal Acad. Amsterdam. Vol. Xvii.
- Wikipedija. (2019). Antimona. Pridobljeno iz: v.Wikipedija.org
- ADVAMEG, INC. (2019). Antimona. Okrevano od: Kemiji.com
- Mc'oneal sabr. (15. september 2018). Kemija: lastnosti in uporaba SB-antimana. Okrevano od: medij.com
- « Zgodovina biogeografije, kakšne študije in raziskovalni primeri
- Vzroki, posledice, rešitve slušnega onesnaževanja »

