Vrste, funkcije in prejemniki anafilotoksinov
- 2060
- 72
- Ignacio Barrows
The Anafilotoksini So fragmenti peptidov z nizko molekulsko maso, ki nastanejo z aktiviranjem komplementalnega sistema. So zelo hidrofilni, s strukturo v Alpha Hall, ki jo povezujejo 3 disulfidni mostovi.
Proteolitično se aktivirajo z rupturo na določenem mestu, ki tvorijo fragmente A in B. Ti peptidi se vežejo na specifične receptorje, izražene na površini celic, in ojačajo različne vnetne reakcije, ki delujejo kot celični aktivatorji.
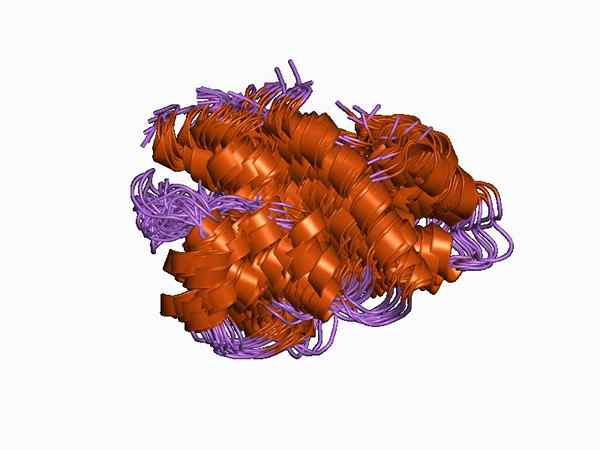
 Protein tipa C5A anafilotoksin. Avtor Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena (https: // creativeCommons.org/licence)], iz Wikimedia Commons.
Protein tipa C5A anafilotoksin. Avtor Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena (https: // creativeCommons.org/licence)], iz Wikimedia Commons. Njegove efektorske funkcije vključujejo kemotoksis, sproščanje vnetnih mediatorjev in granulocitov, mastocitov in makrofagov. V zadnjem času je bilo dokazano, da se anafilotoksini nastajajo lokalno znotraj tkiv s prisotnostjo patogenov.
[TOC]
Fantje
Anafilotoksini vključujejo peptide C3A, C5A in C4A. To so fragmenti nizko molekulske mase (∼10 kDa) α verige komponent komplementa C3, C4 in C5, ki se sprostijo med aktivacijo komplementa.
Vendar je treba opozoriti, da je za C4A dokazano le, da se pridruži sprejemniku z nizko afiniteto in noben specifični sprejemnik ni bil ugotovljen.
C5A je najmočnejši od teh peptidov, to je, da spodbuja vnetje in je privlačen himio za nevtrofilce, makrofage in monocite.
Čeprav imajo nižji vretenčarji komplementne sisteme, za katere se verjame, da delujejo na podoben način kot pri sesalcih, anafiloksin receptor.
Funkcije
Anafilotoksini nastajajo iz encimskega razkola med tečajem aktivacije komplementa skozi klasične, lektine ali alternativne ceste.
Lahko vam služi: flora in favna iz ItalijeV slapu za komplement aktiviranje razcepa C3 ali C5 za pretvorjeni C3 ali C5 vodi do nastajanja velikega fragmenta, C3B ali C5B in majhnega fragmenta peptida, C3A ali C5A.
C3B in C5B nadaljujeta z aktivacijskim slapom komplementa na mikrobnih ali celičnih površinah, C3A in C5A.
Povečajo vaskularno prepustnost, spodbujajo kontrakcije gladkih mišic in sprožijo osvoboditev histamina iz mastocitov in sekretornih zrnc granulocitov in makrofagov.
Poleg tega je C5A, eden najmočnejših peptidov, močan kemoatraente za nevtrofilce in druge levkocite.
Nobene lastnosti ChemioAtrayent niso pripisali C4A, medtem ko se zdi, da je C3A predvsem eozinofilcem, mastociti in hemopoetskim matičnim celicam, krčenje gladkih mišic, povečana prepustnost krvnih kapilar in celo anafilaktični šok.
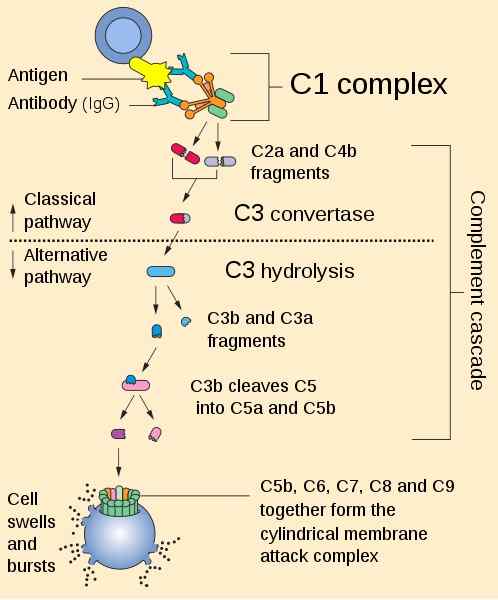
Povzetek poti za aktiviranje komplementa. Avtor Perhelion [Public Domain (https: // creativeCommons.org/licence)], iz Wikimedia Commons.
.
Združenje C5A in C3A s patogenezo
Čeprav ima vnetje C5A in C3A pomembno vlogo pri nadzoru okužbe, je vrsta kliničnih študij pokazala, da so povezani tudi s patogenezo več vnetnih in avtoimunskih bolezni, kot je sepsa, sistemski erithematosus (LES), izguba nosečnosti sindrom antifosfolipidnih protiteles (SAFL), ishemije in astme.
Na ta način se domneva, da bi napad na receptorje in/ali ligande C5A in C3A lahko zmanjšalo neželene vnetne odzive, pa tudi poškodbe tkiv na določenih patoloških pogojih. C5A in C3A sta lahko terapevtska bela učinkovita.
Vam lahko služi: ABO sistem: nezdružljivost, dedovanje in dokazReceptorji
Na splošno anafilotoksini izvajajo večino bioloških dejavnosti s pomočjo treh sorodnih receptorjev, to je; Sprejemnik C3A, sprejemnik C5A in sprejemnik tipa C5A, C5L2.
Pri ljudeh so ugotovljene tri vrste transmembranskih receptorjev, ki posredujejo dejanja anafilotoksinov: C3AR, ki se posebej pridruži C3A; C5AR, ki se veže na C5A; in C5L2, za katerega so lahko trije anafilotoksini ligandi.
Prva dva receptorja sta povezana z regulativnimi G proteini, medtem ko je bil prikazan sprejemnik C5L2.
Porazdelitev teh receptorjev ni omejena na levkocite. Izražene so tudi v številnih vrstah ne -meloidnih celic, vključno s hepatociti, pljučnimi epitelijskimi celicami, endotelnimi celicami, možganskimi astrociti in mikroglijskimi celicami.
V teh vrstah celic lahko posredujejo sodelovanje anafilotoksinov v več žilnih, pljučnih, regenerativnih in degenerativnih nevroloških stanjih.
Če se anafilotoksini ne vežejo na svoje receptorje, jih hitro prebavijo s plazemskimi karboksipi, ki odpravljajo C-terminalni argininski ostanek vsakega peptida.
Argininski derivati so neaktivni ali imajo aktivnosti 10 do 1000 -krat nižje od aktivnosti domačih peptidov.
Dopolnjevanje sistemov v nižjih vretenčarjih
Spodnji vretenčarji, kot so plazilci, dvoživke in ribe, imajo dopolnilne sisteme, ki se v marsičem štejejo za funkcionalno podobne tistim pri sesalcih.
Zaščitni imunski odzivi so pri nekaterih od teh živali dokazali dopolnilo, kot sta citoliza in opsonizacija.
Vam lahko služi: kaj je leptoten?V zadnjem času se je pokazalo, da je tunikado C3A Ciona Intestinalis Ima kemotaktične aktivnosti za tunirane hemocite, kar kaže na prisotnost C3AR receptorja pri teh živalih.
Te protokorde morda nimajo C4A in C5A, zato se verjame, da klasična pot aktiviranja komplementa, ki proizvaja C4A, in litična pot, ki ustvarja C5A, pri teh živalih ni odsoten.
Vendar imajo gnatostomi znane poti za aktivacijo komplementa, molekule C3, C4 in C5 več vrst rib pa so bile ugotovljene. Zanimivo je, da imajo ribe več izoform več komponent komplementa, vključno s C3, C2 / BF, C4 in C5.
Čeprav so za izoforme C3 predlagane različne funkcije, je treba še ugotoviti, ali obstajajo različni receptorji za te izoforme.
Reference
- Yang. Anapofilatokseni. Priročnik bioloških aktivnih peptidov.pp.625-630 http: // dx.doi.org/10.1016/B978-0-12-385095-9.00085-3
- Gennaro R, Simonic T, Negri A, Mottola C, Secchi C, Ronchi S, Romeo D. C5A fragment govejega dopolnila. Čiščenje, biološke testi, aminino-kislinsko zaporedje in druge strukturne študije. Evropski časopis za biokemijo. 1986; 155 (1): 77–86.
- Holland Ch, Lambris JD. Funkcionalni sprejemnik anafilatoksina C5A v teleostski vrsti. Časopis za imunologijo. 2004; 172 (1): 349-355.
- Klos A, Tenner AJ, Johswich K, Ager R, Reis ES, Köhlc J. Vloga anapofiloksa v zdravju in bolezni. Molekularna imunologija. 2009; 46 (14): 2753-2766.
- Ogata RT, Rosa PA, Zepf NE. Zaporedje gena za komponento komplementa C4. Časopis za biološko kemijo. 1989, 264 (28): 16565-16572.
- Peng Q, Li K, vreče SH, Zhou W. Vloga anafilatoksonov C3A in C5A pri uravnavanju prirojenega in prilagodljivega imunskega odziva. Cilji vnetja in alergij. 2009; 8 (3): 236-246.
- « Stranske komunikacijske značilnosti, prednosti, slabosti, primeri
- Tour Diagram, za kaj gre, kako je to, primeri »

