Toplotna struktura alkohola, lastnosti, tveganja in uporabe
- 4567
- 1398
- Lee Farrell
On Termični alkohol To je organska spojina, katere formula je (ch3)3Coh ali t-buoh. To je najpreprostejši terciarni alkohol vseh. Odvisno od temperature okolice je predstavljen kot trdna ali tekoča brezbarvna. Na spodnji sliki prikazujejo na primer svoje brezbarvne kristale.
Ta alkohol ni substrat za encimsko alkoholno dehidrogenazo ali za peroksidazno aktivnost katalaze, zato ga uvrščamo med alkohol, ki ni mogoče omejiti. Zaradi svojih biokemijskih lastnosti velja, da bi lahko bil koristen pri odkrivanju hidroksilov in vivo v nepoškodovanih celicah.

Je eden od štirih izomerov izobutilnega alkohola, saj je manj dovzeten izomer oksidacije in najmanj reaktiven. V naravi ga najdemo v čičeriki in v kasavi ali kasavi, korenini, ki je fermentirana za proizvodnjo alkoholnih pijač.
Toplotni alkohol je zelo topen v vodi in organskih topilih. Njegova glavna uporaba je kot topilo, ki izpolnjuje to vlogo pri izdelavi plastike, parfumov, slikarskih remverses itd.
Kot številne organske spojine je tudi nekoliko strupen, toda v visokih odmerkih ima narkotični učinek, za katerega so značilni glavobol, vahidos, omotica, omotica in propadanje.
[TOC]
Toplotna struktura alkohola
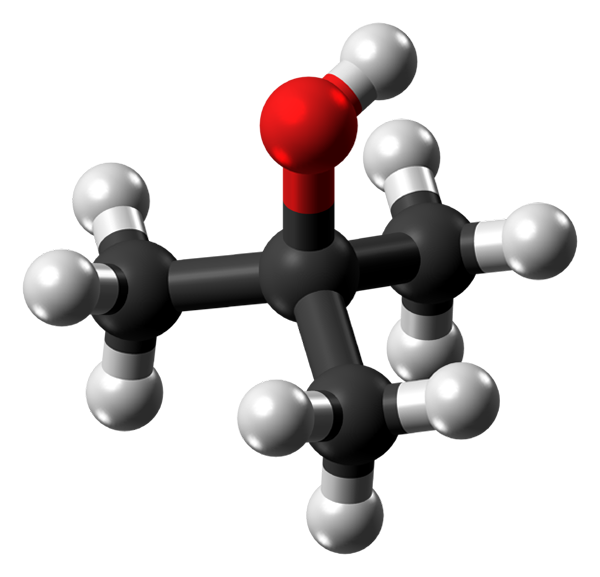
 Molekula toplotnega alkohola. Vir: Jynto prek Wikipedije.
Molekula toplotnega alkohola. Vir: Jynto prek Wikipedije. Na zgornji sliki imate molekularno strukturo toplotnega alkohola z modelom kroglic in palic. Celotna molekula ima globalno tetraedrsko geometrijo, s 3. ogljikom v svojem središču in skupinami3 in oh v svojih točkah.
Če opazimo to strukturo, se razume, zakaj je ta alkohol terciarna: ogljik centra je povezan s tremi drugimi ogljikovimi ogljiki. Nadaljevanje s tetraedrom se lahko spodnji del šteje.
Lahko vam služi: Fehling Reakcija: pripravki, aktivni povzročitelji, primeri, uporabeV tej tolici je skupina OH, ki ustvarja trajni dipol in omogoča tudi, da molekule T-Buoh medsebojno delujejo prek vodikovih mostov; na enak način kot pri molekulah vode in drugih polarnih snovi.
V kristalih T-Buah so ti vodikovi mostovi ključni dejavnik, da molekule ostanejo skupaj; Čeprav ni preveč informacij o tem, kaj je kristalna struktura tega alkohola.
Ko je skupina OH tako blizu in obdana z apolarnimi skupinami3, Molekule vode uspejo hidrirati skoraj ves alkohol med interakcijo z OH. To bi razložilo njegovo veliko topnost v vodi.
Lastnosti
Kemična imena
-Termični alkohol
-Ter-butanol
-2- metil-2-propanol
-2-metilpropan-2-ol.
Molekularna formula
C4H10O o (cho3)3Coh.
Molekularna teža
74,123 g/mol.
Fizični opis
Brezbarvna trdna ali brezbarvna tekočina, odvisno od temperature okolice, saj je tališče 77,9 ° F (25,4 ° C). Nad 77,9 ° F je tekočina.
Vonj
Podobno kot kamfor.
Vrelišče
82,4 ° C.
Tališče
77,9 ° F (25,4 ° C).
točka vžiga
52 ° F (11 ° C). Zaprta skodelica.
Topnost vode
Zelo topno. Pravzaprav je ta alkohol ne glede na razmer, ki je vedno mešan z vodo.
Topnost v organskih topilih
Mešljiv z etanolom, etilnim etrom in topnim v kloroformu.
Gostota
0,78 g/cm3.
Gostota pare
2,55 (z zračnim razmerjem = 1).
Parni tlak
4.1 kPa pri 20 ° C.
Koeficient oktanola/vode
Dnevnik p = 0,35.
Termostabilnost
Nestabilno v vročini
Temperatura samousmernosti
896 ° F (470 ° C).
Vam lahko služi: alikvot (kemija)Razgradnja
Ko se ogreva, lahko sprosti hlape ogljika in izobutilena monoksida.
Toplota za uparjanje
39,07 kJ/mol.
Kalorična zmogljivost
215,37 JK-1mol-1.
Trening entalpija
-360,04 do -358,36 kJmol-1.
Temperatura skladišča
2-8 ° C.
Stabilnost
Je stabilen, vendar nezdružljiv z močnimi oksidacijskimi sredstvi, bakermi, bakrenimi zlitinami, alkalnimi in aluminijastimi kovinami.
Ionizacijski potencial
9,70 ev.
Prag vonja
219 mg/m3 (Nizek vonj).
Lomni količnik
1.382 do 25 ° C.
Konstanta disociacije
PKA = 19.20.
Največja koncentracija pare
5,53 % pri 25 ° C.
Reakcije
-Močna osnova je neprijetna, da povzroči anion alcoksida; Konkretno, terbutoksid (ch3)3Co-.
-Toplotni alkohol reagira z vodikovim kloridom, da tvori terbutil klorid.
(Pogl3)3Coh +hcl => (ch3)3CCL +H2Tudi
Terciarni alkoholi imajo večjo reaktivnost z vodikovimi halogenidi kot sekundarni in primarni alkoholi.
Tveganja
Toplotni alkohol s stikom s kožo povzroča blage lezije, kot so eritem in ne -porodna hiperemija. Poleg tega kože ne prečka. Nasprotno, v očeh povzroči hudo draženje.
Ko se vdiha, povzroči draženje v nosu, grlu in bronhiju. V primeru visoke izpostavljenosti se lahko pojavijo narkotični učinki, stanje zaspanosti, pa tudi zbledi, vahidos in glavobol.
Ta alkohol je eksperimentalno teratogeno sredstvo, zato so ga opazili pri živalih, ki lahko vplivajo na pojav prirojenih motenj.
Kar zadeva njegovo skladiščenje, so njena tekočina in hlapi vnetljivi, zato lahko v določenih okoliščinah ustvari požare in eksplozije.
OSHA je vzpostavila mejo koncentracije 100 ppm (300 mg/m3) Za 8 -urni dan.
Vam lahko služi: odstotne rešitvePrijave
-Toplotni alkohol se uporablja za vključitev toplotne skupine v organske spojine, da se pripravi topna olja v oljih, in trinitro-tter-butleleluene, umetni mošus. Poleg tega predstavlja začetno gradivo za pripravo peroksidov.
-FDA ga je odobrila kot sredstvo za uporabo v komponentah in plastičnih materialih, ki so v stiku s hrano. Uporablja se pri izdelavi sadja, plastike in lakas.
-Je posrednik za proizvodnjo terbutila in tributilfenola klorida. Deluje kot denaturirajoč etanol.
-Postrezite za izdelavo flotacijskih sredstev, kot organsko topilo za odstranjevanje slik in za raztapljanje esenc, ki se uporabljajo v parfumih.
-Uporablja se kot ojačevalnik oktana v bencinu; dodatek za gorivo in gorivo; Topilo, ki ga je treba uporabiti pri čiščenju in kot bedno.
-Termalni alkohol je posredniško sredstvo pri proizvodnji terbutilmetil etra (MTBE) in tributiletil etra (ETBE), ki reagira z metanolom in etanolom.
-Prav tako deluje na enak način pri proizvodnji tributil hidroperoksida (TBHP) z reakcijo z vodikovim peroksidom.
-Uporablja se kot reagent v procesu, znanem kot Curtius Rearreglo.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10th Izdaja.). Wiley Plus.
- Wikipedija. (2019). TERT-butilni alkohol. Pridobljeno iz: v.Wikipedija.org
- Nadstojenkemija. (s.F.). T-butanol. Okrevano od: StrogorganicChemistry.com
- Nacionalni center za informacije o biotehnologiji. (2019). Tert butanol. Baza podatkov Pubchem. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Carey f. Do. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- « Značilnosti in primeri vsebine stališča
- Kaj bi morali otroci in mladi iz 21. stoletja naučiti ravnati v današnjem svetu? »

