Primarna struktura alkohola, lastnosti, nomenklatura, primeri

- 2812
- 513
- Miguel Gutmann DVM
A primarni alkohol To je tisti, v katerem je hidroksilna skupina povezana s primarnim ogljikom; To je kovalentno pritrjeni ogljik na drug ogljik in hidrogeni. Njegova splošna formula je ROH, konkretno RCH2Oh, saj obstaja samo ena najemna skupina R.
RCH Formula R skupina R2Oh, lahko je kdo: veriga, prstan ali heteroatomes. Ko gre za verigo, kratko ali dolgo, je pred najbolj reprezentativnimi primarnimi alkoholi; Med njimi sta metanol in etanol, dva najbolj sintetizirana na industrijski ravni.
 Kozarec za pivo: primer vodne raztopine etilnega alkohola, primarnega alkohola, v organski matrici. Vir: Engin Akyurt prek Pexels.
Kozarec za pivo: primer vodne raztopine etilnega alkohola, primarnega alkohola, v organski matrici. Vir: Engin Akyurt prek Pexels. Fizično so kot drugi alkoholi, njihove vrelne ali fuzijske točke pa so odvisne od stopnje njihovih posledic; Toda kemično so najbolj reaktivni. Poleg tega je njegova kislost boljše od sekundarnih in terciarnih alkoholov.
Primarni alkoholi doživljajo oksidacijske reakcije, ki postanejo široko število organskih spojin: estri in etri, aldehidi in karboksilne kisline. Prav tako lahko trpijo dehidracijske reakcije, postanejo alkeni ali olefini.
[TOC]
Struktura primarnega alkohola
Primarni alkoholi, ki izhajajo iz linearnih alkanov, so najbolj reprezentativni. V resnici pa je mogoče katero koli strukturo, bodisi linearno ali razvejano, razvrstiti znotraj te vrste alkoholov, dokler je skupina OH povezana s CH2.
Torej, strukturno imajo vsi skupne prisotnosti skupine -ch2Oh, imenovan metilol. Značilna in posledica tega dejstva je, da je skupina OH manj preprečena; to pomeni, da lahko vpliva na okolje, ne da bi drugi atomi prostorsko ovirali.
Tudi manj preprečeno OH pomeni, da je atom ogljika, ki ga nosi, izberi2, lahko trpijo nadomestne reakcije prek mehanizma SN2 (Bimolekularna, brez nastanka karbokacije).
Po drugi strani OH z večjo svobodo interakcije z okoljem prevaja kot močnejše intermolekularne interakcije (z vodikovimi mostovi), kar posledično poveča točke fuzije ali vrelišča.
Lahko vam služi: nikelj hidroksid (III): struktura, lastnosti, uporabe, tveganjaZgodi se tudi s svojo topnostjo v polarnih topilih, dokler skupina R ni zelo hidrofobna.
Lastnosti
Kislost
Primarni alkoholi so iz vseh najbolj kislih. Da se alkohol obnaša kot Brnsted kislina, mora ion h podariti+ Na sredini, recimo vodo, postati alcoksidni anion:
Roh + h2Zlato- + H3Tudi+
Negativna obremenitev rdeče-, konkretno od RCH2Tudi-, Začutite manj odbojnosti na strani elektronov obeh C-H vezi, kot z elektroni C-R vezi.
Najemna skupina nato izvaja največjo odbojnost in destabilizira RCH2Tudi-; vendar ne toliko v primerjavi z dejstvom, da če sta dve ali tri skupine R, kot je to pri sekundarnih in terciarnih alkoholih.
Drug način za razlago največje kislosti primarnega alkohola je skozi razliko v elektronegativnosti, kar ustvarja dipolski trenutek: H2Cδ+-Tudiδ-H. Kisik privlači elektronsko gostoto obeh CH2 kot H; Pozitivna delna obremenitev ogljika nekoliko odvrne vodik.
Skupina R prenaša nekaj svoje elektronske gostote v CHO2, kar pomaga zmanjšati svojo pozitivno delno obremenitev in z njim odbojnost za obremenitev vodika. Bolj ko so skupine RA, nižje je odbojnost in zato je trend H sprostiti kot H+.
PKA
Primarni alkoholi veljajo za najšibkejše kisline kot voda, z izjemo metilnega alkohola, ki je nekoliko močnejši. PKA metilnega alkohola je 15,2; In PKA etilnega alkohola je 16,0. Medtem je vodni PKA 15,7.
Vendar se lahko voda, ki velja za šibko kislino, kot alkoholi, pridruži H+ Preoblikovati v hidrium ion, h3Tudi+; to pomeni, da se obnaša kot baza.
Na enak način lahko primarni alkoholi zajamejo vodik; zlasti v nekaterih reakcijah, ki so na primer pri njihovi preobrazbi v alkene ali olefine.
Kemične reakcije
Najem HalogeNuros Formacija
Alkoholi reagirajo z vodikovimi halogenidi, da proizvajajo alkil halogenide. Reaktivnost alkoholov pred vodikovimi halogenidi se spusti v naslednjem vrstnem redu:
Vam lahko služi: ogljikTerciarni alkohol> sekundarni alkohol> primarni alkohol
Roh +hx => rx +h2Tudi
RX je primarni alkil halogenid (izberite3Cl, ch3Pogl2Br itd.).
Drug način za pripravo alkil halogenuros je skozi reakcijo tionilo klorida, sintetičnega reagenta, s primarnim alkoholom, ki postane alkil klorid. Tionilo klorid (socl2) zahteva reagiranje prisotnosti piridina.
Pogl3(Pogl2)3Pogl2Oh +Socl2 => Ch3(Pogl2)3Pogl2Cl +Torej2 + Hcl
Ta reakcija ustreza halogenaciji 1-penola, da postane 1-cloropentano v prisotnosti piridina.
Oksidacija primarnih alkoholov
Alkoholi lahko oksidiramo v aldehide in karboksilne kisline, odvisno od reagenta. Pyridinium klorokromat (PCC) oksidira primarni alkohol v aldehid z uporabo diklorometana kot topila (ch2Cl2)::
Pogl3(Pogl2)5Pogl2OH => CHO3(Pogl2)5Coh
To je oksidacija 1-heptanola v 1-heptanalu.
Medtem, kalijev permanganat (kmno4) Alkohol najprej in nato oksidira v aldehid do karboksilne kisline. Ko se kalijevi permanganat uporablja za oksidacijo alkohola.
Pogl3(Pogl2)4Pogl2OH => CHO3(Pogl2)4COOH
To je oksidacija 1-heksanola do heksanojske kisline.
S to metodo je težko dobiti aldehid, saj zlahka oksidira karboksilno kislino. Podobno situacijo opazimo, ko se kromična kislina uporablja za oksidacijo alkoholov.
E éterres Formacija
Primarni alkoholi lahko postanejo etri, ko se segrejejo v prisotnosti katalizatorja, običajno žveplove kisline:
2 rch2Oh => rch2Och2R +h2Tudi
Organska tvorba ezarejev
Kondenzacija alkohola in karboksilne kisline, Fisher esterifikacija, katalizirana s kislino, proizvaja ester in vodo:
Vam lahko služi: karbokacija: tvorba, značilnosti, vrste, stabilnostR'oh +rcooh rcoor ' +h2Tudi
Dobro znana reakcija je etanola z ocetno kislino, da se daje etil acetat:
Pogl3Pogl2Oh +ch3COOH CH3COOHCH2Pogl3 + H2Tudi
Primarni alkohol je najbolj dovzeten za reakcije sterifikacije Fischerja.
Dehidracija
Pri visokih temperaturah in v kislem mediju, običajno žveplove kisline, alkoholi dehidrirajo, da povzročijo alkene z izgubo molekule vode.
Pogl3Pogl2OH => H2C = pogl2 + H2Tudi
To je dehidracijska reakcija etanola na etilen. Ustreznejša splošna formula za to vrsto reakcije, zlasti za primarni alkohol, bi bila:
Rch2Oh => r = cho2 (Kaj je enako RC = CH2)
Nomenklatura
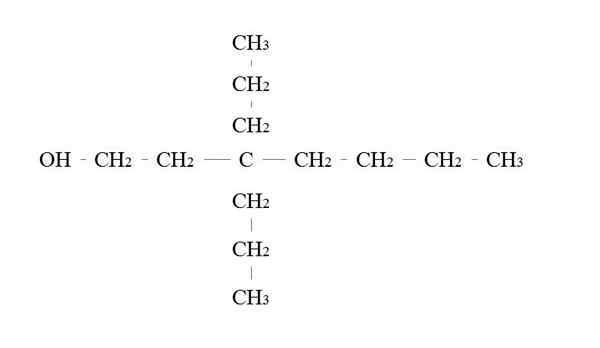 Primarni primer alkohola. Vir: Gabriel Bolívar.
Primarni primer alkohola. Vir: Gabriel Bolívar. Pravila za poimenovanje primarnega alkohola so enaka za ostale alkohole; Z izjemo, da včasih ni treba našteti nosilca OH.
Na zgornji sliki je glavna veriga sedem ogljikovih ogljikov. Carbon, povezan z OH, je dodeljen številka 1, nato pa začne šteti od leve proti desni. Njegovo ime IUPAC je torej: 3.3-dietilheptanol.
Upoštevajte, da je to primer zelo razvejenega primarnega alkohola.
Primeri
Končno se nekateri primarni alkoholi omenjajo glede na njihovo tradicionalno in sistematično nomenklaturo:
-Metil, pogl3Oh
-Etil, pogl3Pogl2Oh
-N-propil, pogl3Pogl2Pogl2Oh
-N-hexyl, pogl3Pogl2Pogl2Pogl2Pogl2Pogl2Oh
Te izhajajo iz linearnih alkanov. Drugi primeri so:
-2-Fenyletol, c6H5Pogl2Pogl2Oh (c6H5 = benzenski obroč)
-2-propen-1-OC (Allilični alkohol), CHO2= Chch2Oh
-1,2-taodiol, pogl2Oh2Oh
-2-kloroetanol (etileclorhidrin), CLCH2Pogl2Oh
-2-buten-1-ol (krotilni alkohol), ch3Ch = chch2Oh
Reference
- Morrison, r.T. In Boyd, r. N. (1987). Organska kemija. (5ta Izdaja). Addison-Wesley Iberoamericana
- Carey, f. Do. (2008). Organska kemija. (6ta Izdaja). McGraw-Hill, Intermerica, uredniki S.Do.
- Mel Science. (2019). Kako poteka oksidacija primarnih alkoholov. Okreval od: melscience.com
- Royal Society of Chemistry. (2019). Opredelitev: Primarni alkoholi. Okrevano od: RSC.org
- Chriss e. McDonald. (2000). Oksidacija primarnih alkoholov do estrov: trije povezani preiskovalni poskusi. J. Kem. Educa., 2000, 77 (6), P 750. Doi: 10.1021/ED077P750

