Značilnosti aktina, struktura, nitke, funkcija
- 1933
- 482
- Mr. Shane Larkin
The Aktin Je citosolni protein, ki tvori mikrofilamente. V evkariotih je aktin eden najpogostejših beljakovin. Na primer, predstavlja 10% po teži celotnega beljakovin v mišičnih celicah; in med 1 in 5% beljakovin v celicah, ki ne.
Ta protein poleg vmesnih nitk in mikrotubul tvori citoskelet, katerega glavna funkcija je mobilnost celice, vzdrževanje celične oblike, delitev celic in gibanje organel v rastlinah, glivah in živalih.
 Vir: Sarcomere.SVG: David Richfield (uporabnik Slashme) Izvedeno delo: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]
Vir: Sarcomere.SVG: David Richfield (uporabnik Slashme) Izvedeno delo: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]] Izoforme aktina citoskeleta.
Z evolucijskega vidika je aktin zelo ohranjen beljakovine. Pri različnih vrstah je približno 90% homologije zaporedja. V enoceličnih organizmih en sam gen kodira aktin Isaform. Medtem ko so v večceličnih organizmih, različni geni kodirajo več aktinskih isaforms.
Actin sta bila skupaj z miozinom ključne strukture v evolucijski prihodnosti evkariontskih organizmov in njihove diverzifikacije, saj so omogočili gibanje v odsotnosti drugih struktur, kot sta flagelov in cilia.
[TOC]
Struktura: aktin nitke
Actin je en sam polipeptidni verižni kroglični protein. V mišici ima aktin molekulsko maso približno 42 kDa.
Ta protein ima dve domeni. Vsak ima dve poddomenami in razcep med domenami. ATP-MG+2 se pridruži dnu razcep. Terminali amino in karboksil se združijo v poddomena.
Actina G in Actina F
Obstajata dve glavni obliki aktina: aktinski monomer, imenovan Actina G; in nitast polimer, sestavljen iz aktinskih g monomerov, imenovan Actina F. Aktinske filamente, ki jih opazimo z elektronsko mikroskopijo, imajo ozka in široka območja, premera 7 nm oziroma 9 nm.
V celotni nitki Actin Monomers tvori dvojno vijačnico, stisnjen. Enota, ki se ponavlja v celotni nitki, je sestavljena iz 13 propelerjev in 28 aktinskih monomerov in ima razdaljo 72 nm.
Actin filament ima dva konca. Eden tvori razcep, ki povezuje ATP-MG+2, ki se nahaja v isti smeri v vseh aktinskih monomerih nitke, imenovane konec (-); In drugi konec je nasprotno, imenovan konec (+). Zato se reče, da ima aktinska filament polarnost.
Velikokrat so te komponente znane kot mikrofilamente, saj so komponente citoskeleta, ki predstavljajo manj premera.
Kje najdemo aktin?
Actin je izjemno pogost protein v evkariontskih organizmih. Od vseh celičnih beljakovin je aktin približno 5 do 10% - odvisno od vrste celice. V jetrih, na primer, vsaka od celic, ki jo sestavljajo, ima skoraj 5.108 Aktinske molekule.
Značilnosti
Dve obliki aktina, monomera in filamenta nenehno najdemo v dinamičnem ravnovesju med polimerizacijo in depolimeri. Na splošno obstajajo tri značilnosti tega pojava:
1) aktinske filamente so značilne za strukturo mišičnega tkiva in citoskeleta evkariontskih celic.
Vam lahko služi: 10 značilnosti najbolj izjemnih lipidov2) Polimerizacija in depolimerizacija je dinamični postopek, ki je reguliran. Kjer je polimerizacija ali združevanje aktinskih monomerov G-ATP-MG+2 Zgodi se na obeh koncih. Da se ta postopek zgodi, je odvisen od pogojev medija in regulativnih beljakovin.
3) Nastanek žarkov in mrežic, ki sestavljajo aktin citoskelet, daje silo gibljivosti celic. To je odvisno od beljakovin, ki sodelujejo pri oblikovanju križnih vezi.
Funkcije
Krčenje mišic
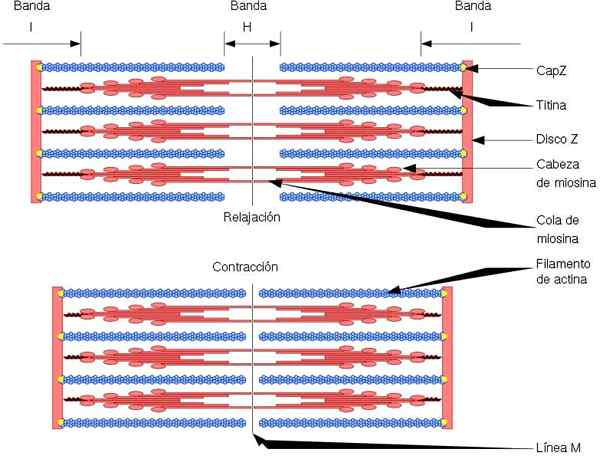
Funkcionalna in strukturna enota skeletne mišice je sarcomer, ki ima dve vrsti nitk: tanke filamente, ki jih tvori aktin, in debele filamente, ki jih tvori miozin. Obe nitki sta organizirani izmenično, natančno geometrijski način. Omogoči krčenje mišic.
Tanke nitke so zasidrane v regijah, imenovanih Discs Z. To regijo je sestavljeno iz vlaknaste mreže, v katerem se nahaja protein Capz in do katere so konci (+) aktinskih nitk zasidrani. To sidro preprečuje končno depolerizacijo (+).
Po drugi strani se na koncih (-) aktinskih nitk nahaja tropomodulin in jih ščiti pred depolimerjo. Poleg aktina imajo tanke filamente tropomiozin in troponin, ki imata funkcijo nadzorovanja interakcij z aktomiozinom.
Kako pride do krčenja mišic?
Med krčenjem mišic debele filamente premikajo in potegnejo tanke filamente proti sredini sarcomera. To povzroči drsnik debelih in tankih vlaken.
Tako dolžina debelih in tankih filamentov ostane konstantna, vendar poveča prekrivanje med obema nitkoma. Dolžina sarcomerja se zmanjšuje s zasidranjem tankih filamentov na z diske z.
Kako se ustavi krčenje mišic?
ATP je energetska valuta celice. Zato je skoraj vedno na voljo v živih mišičnih tkivih. Ob upoštevanju zgoraj navedenega morajo obstajati mehanizmi, ki omogočajo sprostitev mišic in aretacija kontrakcij.
Dva proteina, imenovana tropomiozin in troponin, imata temeljno vlogo pri tem pojavu. Ti sodelujejo pri blokiranju sindikalnih mest miozina (s čimer preprečujejo njihovo zvezo z aktinom). Kot rezultat tega se mišica sprosti.
Nasprotno, ko žival doživi pojav, znan kot Mortis Rigor. Oseba, ki je odgovorna za to utrjevanje telesa, je blokada interakcije med miozinom in aktinom, kmalu po smrti živali.
Ena od posledic tega pojava je potreba po ATP za sproščanje obeh beljakovinskih molekul. Logično je, da v mrtvih tkaninah ni razpoložljivosti ATP in ta izdaja se ne more zgoditi.
Druge vrste gibanja
Isti mehanizem, ki ga opisujemo (kasneje bomo poglobili mehanizem, ki temelji na gibanju) ni omejen na mišične kontrakcije živali. Odgovoren je za ameboidna gibanja, ki jih opazujemo v amoebi in v nekaterih kolonialnih kalupih.
Na enak način citoplazemsko gibanje, ki ga opazujemo v algah in kopenskih rastlinah, vodijo podobni mehanizmi.
Uravnavanje polimerizacije in depolimerizacije aktinske filamente
Krčenje gladkega mišičnega tkiva in celic povzroči povečanje aktina F in zmanjšanje aktina G. Polimerizacija aktina se pojavi v treh stopnjah: 1) nukleacija, počasen korak; 2) raztezanje, hiter korak; in 3) stabilen status. Hitrost polimerizacije je enaka hitrosti depolimerizacije.
Vam lahko služi: fixistična teorija: koncept, postulati in avtorjiActin filament do konca (+) raste hitreje kot konec (-). Hitrost raztezanja je sorazmerna s koncentracijo aktinskih monomerov v ravnotežju z aktinskimi filamenti, imenovana kritična koncentracija (CC).
CC za konec (+) je 0,1 µm, za konec (-) pa 0,8 µm. To pomeni, da je za polimerizacijo konca potrebna 8 -krat manj koncentracije aktinskih monomerov (+).
Polimerizacijo aktina regulirajo predvsem prevare beta4 (TB4). Ta beljakovine združujejo aktin in ga obdrži, kar preprečuje polimeriko. Medtem ko propilin spodbuja aktinsko polimerizacijo. Profil se veže na aktinske monomere, kar olajša polimerizacijo na koncu (+) z disociacijo kompleksa Actin-TB4.
Drugi dejavniki, kot je povečanje ionov (NA+, K+ ali mg+2) nakloniti se oblikovanju nitk.
Nastajanje citoskeleta aktina
Oblikovanje aktinskega citoskeleta zahteva izdelavo navzkrižnih vezi med aktinskimi nitki. Te povezave tvorijo beljakovine, katerih vrhunci so: imajo domene združenja do aktina; Mnogi imajo homologne domene na kalponinu; in vsaka vrsta beljakovin je izražena v določeni vrsti celice.
V Philopodes in Stresnih vlaknih med aktinskimi nitkami izdelujeta fascin in filamin. Ti beljakovini naredijo aktinske filamente vzporedne ali imajo različne kote. Zato aktinske filamente definirajo obliko celice.
Celično območje z najvišjo količino aktinskih nitk se nahaja v bližini plazemske membrane. Ta regija se imenuje Cortex. Kortikalni citoskelet je organiziran v različnih oblikah, odvisno od vrste celice in se s pritrditvijo beljakovin poveže s plazemsko membrano.
Nekateri najbolje opisani citoskeleti so mišične celice, trombociti, epitelijske celice in eritrociti. Na primer, v mišičnih celicah se distrofinski fikcijski protein pridruži aktinskim nitkam v obsežen glikoproteični kompleks membrane. Ta kompleks se veže na zunajcelične matrične beljakovine.
Model interakcije z aktin-miozinom
Raziskovalci Rayment -Bred so predlagali model s štirimi koraki, da bi razložili interakcijo aktina in miozina. Prvi korak se zgodi z zvezo ATP do miozinskih glav. Ta zveza ustvari konformacijsko spremembo v beljakovinah in jo sprosti iz aktina v majhni nitki.
Nato se ATP hidrolizira na ADP in sprosti anorganski fosfat. Molekula miozina je zasidrana v novo podenoto Actin, ki ustvarja visoko energijsko stanje.
Sprostitev anorganskega fosfata prinaša s seboj spremembo miozina, ki se vrne v začetno konformacijo in gibanje majhnih filamentov glede na debele nitke glede na debele filamente. To gibanje povzroča gibanje obeh koncev sarcomerja in se jim približa.
Zadnji korak vključuje izdajo ADP. Na tej točki je glava miozina brezplačna in se lahko pridruži novi molekuli ATP.
Lahko vam služi: biologija: zgodovina, kakšne študije, veje, bazeGibanje celic, ki ga poganja polimerizacija aktina
Rektorska gibljivost je vrsta celične gibljivosti. Koraki te vrste gibljivosti so: projekcija vodilne osi adhezije na podlagi; adhezija na podlagi; zadaj; in des-adhezija.
Projekcija vodilne osi zahteva sodelovanje beljakovin, ki sodelujejo pri polimerizaciji in depolimerizaciji aktinskih filamentov. Vodilna os se nahaja v celični skorji, imenovana Lamellipodio. Koraki projekcije osi so:
- Aktivacija receptorjev z zunajceličnim signalom.
- Oblikovanje aktivnih GTPAS in 4,5-bishoposfatnega fosfoinozitola (PIP2).
- Aktivacija beljakovin WASP/SCAR in ARP2/3, ki se vežejo na aktinske monomere, da tvorijo posledice v aktinskih filamentih.
- Hitra rast aktinskih filamentov, na koncu okrašena z miozinom, razvejano. Potisk membrane se proizvaja naprej.
- Vrhunec raztezka, ki ga proizvajajo pokrovni beljakovine.
- ATP hidroliza, pritrjena na aktin v najstarejših nitkah.
- Depolimerizacija aktin-ad filamentov, ki jih spodbuja ADF/Cofilina.
- ADP izmenjava ATP, ki jo katalizira profilaina, ustvarja aktin G-ATP, pripravljen za začetek elongarjev posledic.
Actin -povezane bolezni
Mišična distrofija
Mišična distrofija je degenerativna bolezen skeletnih mišic. Je podedovana in je povezana z X kromosomom. V glavnem prizadene moške z visoko frekvenco v populaciji (eden od 3.500 moških). Matere teh moških so asimptomatske heterorozne in lahko primanjkuje družinske zgodovine.
Obstajata dve obliki mišične distrofije, Duchenne in Becker, obe pa povzročata okvare v genu distrofina. Te napake so sestavljene iz delecij, ki odpravljajo aksone.
Distrofin je protein (427 kDa), ki tvori navzkrižne vezi med aktinskimi nitkami. Ima obvladovanje zveze, da bi se v N-terminalu Actin, in mojstrstvo membranske zveze v C-terminalu. Med obema domenama je tretja cevasta domena, ki jo tvori 24 ponovitev v tandemu.
V mišičnem kortikalnem retikulumu distrofin sodeluje v zvezi aktinskih filamentov do plazemske membrane s pomočjo glikoprotejskega kompleksa. Ta kompleks se veže tudi na zunajcelične matrične beljakovine.
Pri bolnikih, ki nimajo funkcionalnega distrofina, z mišično distrofijo Duchenne kortikalni citoskelet ne podpira plazemske membrane. Posledično je plazemska membrana poškodovana zaradi stresa ponavljajočih se kontrakcij mišic.
Reference
- Devlin, t.M. 2000. Biokemija. Uredništvo Reverté, Barcelona.
- Gunst, s.J., in Zhang, w. 2008. Aktinska citoskeletna dinamika v gladkih mišicah: nova paradigma za regulacijo krčenja gladkih mišic. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, str., Baltimore, d., Darnell, J. 2003. Celična in molekularna biologija. Uredništvo Medica Panamericana, Buenos Aires, Bogota, Caracas, Madrid, Mehika, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Lehning-principles biokemije. W.H. Freeman, New York.
- Pfaendtner, j., Od križa in. M., Voth, g. 2010. Preoblikovanje aktinskih nitk s faktorjem depolimerizacije aktina/kofilin. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Celična gibljivost, ki jo poganja montaža in demontaža aktinskih filamentov. Cell, 112: 453-465.
- « Apolipoproteini, kaj so, funkcije, vrste
- Primarna struktura alkohola, lastnosti, nomenklatura, primeri »

