Isoamilico alkoholna struktura, lastnosti, uporabe in tveganja
- 2167
- 177
- Stuart Armstrong
On Izoamilni alkohol To je organska spojina, katere formula je (ch3)2Chch2Pogl2Oh. Kemično gledano je razvejan primarni alkohol in predstavlja enega od izomerov pentanola, imenovanega Amyl Alcohols (C5H12Da).
Kot mnogi alkoholi z nizko molekulsko maso, je tudi brezbarvna tekočina pri sobni temperaturi. To omogoča in olajša, da se uporablja kot topilo za različne aplikacije; Poleg tega, ko po zavrženju ne izvaja preveč negativnih učinkov na ekosistem.
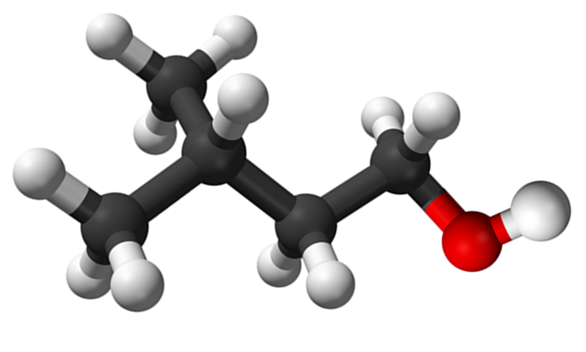
 Izoamilična molekula alkohola. Vir: Claudio Pistilli de Wikipedia.
Izoamilična molekula alkohola. Vir: Claudio Pistilli de Wikipedia. Medtem ko gre za posredniški material v sintezi amilo acetata za izdelavo dišav banane, je njegov vonj neprijeten in podoben kot hruške.
Poleg tega, da služi kot topilo več bioloških snovi in kot posrednik pri sintezi drugih acetatov, zmanjšuje površinsko napetost nekaterih industrijskih formulacij, kar preprečuje oblikovanje pene. Zato se uporablja v mikroemulgiranih sistemih.
Glede svojega naravnega izvora je bil v horomonah Hornetsov najdeno izoamilični alkohol in v črnih tartufih, vrsto gliv, ki se nahajajo na evropskem jugovzhodu.
[TOC]
Struktura Isoamilico
Na zgornji sliki je bila prikazana molekula izoamilne alkohola, prikazana z modelom kroglic in palic. Desno od istega, rdečkasta krogla ustreza atomu kisika skupine OH, značilna za vse alkohole; Medtem ko je na levi, je gazirano okostje z metilno skupino, CHO3, Brancing struktura.
Z molekulskega vidika je ta spojina dinamična za atome s hibridacijami SP3, olajšanje vrtenja njihovih povezav; Dokler ne povzročata OH in CHO3.
Prav tako je treba omeniti njeno amfifilno značilnost: ima apolarni ali hidrofobni konec, ki ga sestavlja veriga (ch3)2Chch2Pogl2-, in polarna ali hidrofilna glava, skupina OH. Zaradi te opredelitve dveh posebnih področij različnih polarnosti je ta alkohol tenseaktiven; In od tu je zaradi uporabe za mikroemulzije.
Vam lahko služi: pravilo vzvodaMedmolekularne interakcije
Glede na prisotnost skupine OH, izoamilna molekula alkohola predstavlja trajni dipolski trenutek. Posledično dipol-dipol.
Medtem ko veja glavnih verig zmanjšuje učinkovite interakcije med molekulami, vodikovi mostovi v tem alkoholu kompenzirajo ta spust, zaradi česar se tekočina zavre pri 131 ° C, temperatura pa višja od vrele vode vode.
Ne zgodi se s svojo trdno ali "ledom", ki se topi na -117 ° C, kar kaže na to, da njegove medmolekularne interakcije niso dovolj močne, da bi molekule urejale; še posebej, če skupina CHO3 ki veje glavna veriga preprečuje boljši stik med molekulami.
Lastnosti
Fizični videz
Brezbarvna tekočina.
Vonj in okus
Odganja neprijeten vonj, podoben vonju hruške, in ima oster okus.
Molarna masa
88,148 g/mol.
Gostota
0,8104 g/ml pri 20 ° C. Zato je manj gosta kot voda.
Gostota hlapov
Je 3,04 -krat gostejši od zraka.
Parni tlak
2,37 mmHg pri 25 ° C.
Vrelišče
131.1 ° C.
Tališče
-117,2 ° C.
točka vžiga
43 ° C (zaprta skodelica).
Temperatura samostojnosti
340 ° C.
Topnost
V vodi je relativno topen: 28G/l. To je zato, ker zelo polarne molekule vode ne čutijo posebne afinitete za gazirano izoamilno alkoholno verigo. Če je mešano, bi opazili dve fazi: nižja, ki ustreza vodi, in nadrejeni, kot izoamilni alkohol.
V nasprotju s tem je veliko bolj topna v manj polarnih topilih, kot so: aceton, eter, kloroform, etanol ali ledena ocetna kislina; in tudi v oljnem etru.
Lahko vam služi: laboratorijski termometer: značilnosti, za kaj je, uporaba, primeriGoo
3.738 cp pri 25 ° C.
Površinska napetost
24,77 DINS/CM A 15 ° C.
Lomni količnik
1.4075 do 20 ° C.
Toplotna zmogljivost
2,382 kJ/g · k.
Prijave
Surovina
Od izoamiličnega alkohola drugih estrov, tiofen in droge, kot so amilo nitrit, validal (isavalerate mentitel), bromisoval (bromobalerilurea), korvalol (amobarbital) (amobarbital) (amobarbital) (amobarbital) (amobarbital) (amobarbital).
Dišave
Poleg tega, da se uporablja za sintezo amilo acetata, ki ima bananovo aromo, dobimo tudi druge dišave sadja, kot so marelica, pomaranče, sliva, češnja in slad. Zato je nujen alkohol pri izdelavi številnih izdelkov užitnih ali kozmetike.
Antisumant
Z zmanjšanjem površinske napetosti spodbuja njegovo uporabo v mikro -emulgiranih sistemih. Praktično se izogibajte pospešenemu tvorbi mehurčkov in jih zmanjšate v velikosti, da jih zlomijo.
Prav tako pomaga bolje določiti vmesnik med vodnimi in organskimi fazami med ekstrakcijami; Na primer, dodamo ga v mešanico ekstraktorja fenol-kloroform v razmerju 25: 1. Ta tehnika je namenjena ekstrakciji DNK.
Ekstrakcije
Isoamilni alkohol vam omogoča tudi pridobivanje maščob ali olj iz različnih vzorcev, na primer mleko. Prav tako raztopimo parafinski vosek, črnila, guma, laki in celulozni estri.
Nadaljevanje z ekstrakcijami lahko dobite fosforno kislino iz železovih fosfatskih mineralnih raztopin.
Tveganja
Skladiščenje in reaktivnost
Kot vsaka tekočina, ki oddaja vonjave, lahko predstavlja skoraj tveganje za požar, če je kraj, kjer je njegova temperatura preveč shranjena, še bolj, če že obstaja vir toplote.
Pod temi pogoji preprosto deluje kot gorivo, hrani plamen in celo izkorišča svoj zabojnik. Ko opečete, sprostite hlape, ki lahko vplivajo na zdravje in povzročijo zadušitev.
Vam lahko služi: kvantitativna analiza v kemiji: meritve, pripravaDrugi vzroki, ki jih izoamilični alkohol zažge, je, da ga mešajo ali reagirajo s snovmi, kot so: peroksidi, brome.
Zdravje
Ob stiku s kožo lahko dražite in izsušite. Simptomi pa so resnejši, če se predolgo vdihnejo (kašelj, opekline nosu, grlo in pljuča) ali če jih zaužijemo (glavobol, slabost, driska, bruhanje, omotica in izguba znanja).
In končno, ko se razlije v očeh, jih draži in jim lahko celo nepovratno škodi. Na srečo vam vonj "alkoholnih hrušk" omogoča, da ga zaznate v primeru pobega ali razlitja; Poleg tega je to spojina, ki jo je treba manipulirati s spoštovanjem.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Wikipedija. (2019). Izoamilni alkohol. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Izoamilni alkohol. Baza podatkov Pubchem. Cid = 31260. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Zhang Yu in Muhammed Mamoun. (17. septembra 2008). Ekstrakcija fosforne kisline iz nitratnih raztopin z izoamilnim alkoholom. Ekstrakcija topila in ionska izmenjava letnik 6, 1988 - številka 6. doi.org/10.1080/07366298808917973
- Ministrstvo za zdravje v New Jerseyju. (2008). Izoamilni alkohol. [PDF]. Okreval od: NJ.Gov
- Kat Chem. (2019). Izoamilni alkohol. Okreval od: Kat-Chem.HU
- Chemoxy International Ltd. (s.F.). Izoamilni alkohol. Okrevano od: kemoksi.com
- « Triethilaminska struktura, lastnosti, uporabe in tveganja
- Zgodovina in pomen zastave Liechtenstein »

