Triethilaminska struktura, lastnosti, uporabe in tveganja

- 1275
- 104
- Ricky Dach
The trietilamin Gre2Pogl3)3 ali mrežo3. Tako kot drugi tekoči amini predstavlja tudi vonj, podoben vonju amoniaka, pomešanega z ribami; Njegovi hlapi naredijo dolgočasno in nevarno manipulirati s to snovjo brez ustreznega ekstratorja ali oblačil.
Poleg ustreznih formul je na tej spojini običajno skrajšana kot ASD; Vendar to lahko povzroči zmedo z drugimi amini, kot je trietanolamin, N (Ethoh)3, ali tetraetilamonium, kvartarna amina, neto4+.
 Trietilaminski okostje. Vir: Mesice [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]
Trietilaminski okostje. Vir: Mesice [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]] Iz svojega okostja (nadrejena podoba) lahko rečemo, da je trietilamin precej podoben amoniaku; Medtem ko ima drugi trije vodiki, NH3, Prva ima tri etilne skupine, n (ch2Pogl3)3. Njegova sinteza se začne pri zdravljenju tekočega amoniaka z etanolom, ki se pojavi alkilacijo.
Mreža3 Lahko tvoriš higroskopsko sol s HCl: trietilamin klorid, neto3· HCl. Poleg tega sodeluje kot homogeni katalizator pri sintezi estrov in amide, zato je nujno topilo v organskih laboratorijih.
Skupaj z drugimi reagenti omogoča oksidacijo primarnih in sekundarnih alkoholov aldehidov oziroma ketonov. Tako kot amonijak je osnova, zato lahko z nevtralizacijskimi reakcijami tvori organske soli.
[TOC]
Struktura trietilamina
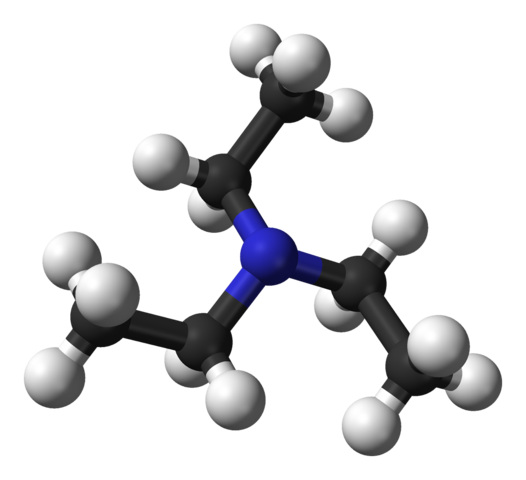 Struktura trietilamina. Vir: Benjah-BMM27 [javna domena].
Struktura trietilamina. Vir: Benjah-BMM27 [javna domena]. Zgornja slika prikazuje strukturo trietilamina z modelom kroglic in palic. V središču molekule se nahaja atom dušika, ki ga predstavlja modrikasto krogla; In povezane z njim, tri etilne skupine, kot majhne veje črne in črne sfere.
Čeprav niso s prostim očesom, je na atomu dušika nekaj ne skupnih elektronov. Ta dva elektrona in tri skupine -CH2Pogl3 Doživljajo elektronske odbojnosti; Toda po drugi strani prispevajo k določitvi dipolnega molekule.
Vam lahko služi: cikloalcanos: lastnosti, reakcije, uporabe, primeriVendar je tak dipolski trenutek nižji od trenutka, na primer dietilamina, NHET2; In tudi nima možnosti oblikovanja vodikovih mostov.
To je zato, ker v trietilaminu ni N-H vezi in posledično opazimo manjše fuzije in vrelišča v primerjavi z drugimi amini, ki delujejo na tak način.
Medtem ko obstaja rahel dipolski trenutek, disperzijske sile med etilnimi skupinami neto molekul ni mogoče izključiti3 sosedi. Če dodamo ta učinek, je upravičeno, zakaj, čeprav je trietilamin hlapna, zavre okoli 89 ° C, zahvaljujoč relativno veliki molekularni masi.
Lastnosti
Fizični videz
Brezbarvna tekočina z neprijetnim vonjem amoniaka in rib.
Molarna masa
101.193 g/mol.
Vrelišče
89 ° C.
Tališče
-115 ° C. Upoštevajte, kako šibke medmolekularne sile, ki združujejo molekule trietilamina v svoji trdni snovi.
Gostota
0,7255 g/ml.
Topnost
Je relativno topen v vodi, 5,5 g/100g pri 20 ° C. Spodaj 18,7 ° C, je po Pubchemu s tem celo mešljiv.
Poleg tega, da se "sprijaznimo" z vodo, je topno tudi v acetonu, benzenu, etanolu, etru in parafinu.
Gostota hlapov
3.49 v zvezi z zrakom.
Parni tlak
57,07 mmHg pri 25 ° C.
Henry Constant
66 μmol/pa · kg.
točka vžiga
-15 ° C.
Temperatura samostojnosti
312 ° C.
Toplotna zmogljivost
216,43 kJ/mol.
Toplota zgorevanja
10.248 apno/g.
Toplota za uparjanje
34,84 kJ/mol.
Površinska napetost
20,22 n/m a 25 ° C.
Lomni količnik
1.400 do 20 ° C.
Goo
0,347 MPA · S pri 25 ° C.
Osnovna konstanta
Trietilamin ima PKB, ki je enak 3,25.
Basicy
Osnovo za to amin lahko izrazimo z naslednjo kemijsko enačbo:
Vam lahko služi: sintetični polimeriMreža3 + Ha nhet3+ + Do-
Kje je šibka kislinska vrsta. Par NHET3+Do- Tvori tisto, kar postane terciarna amonijeva sol.
NHET konjugacijska kislina3+ Je bolj stabilen kot amonij, NH4+, Ker tri etilne skupine dajejo del svoje elektronske gostote, da zmanjšajo pozitivno obremenitev dušikovega atoma; Zato je trietilamin bolj osnoven kot amonijak (vendar manj osnoven kot OH-).
Prijave
 Reakcije, ki jih katalizira trietilamin. Vir: Tachymètre [javna domena].
Reakcije, ki jih katalizira trietilamin. Vir: Tachymètre [javna domena]. Basicy, v tem primeru se nukleofilnost trietilamina uporablja za katalizacijo sinteze estra in amidov iz skupnega substrata: acil klorid, rcocl (superiorna slika).
Tu brez dušikovih elektronov napade karbonilno skupino in tvori posrednik; ki ga zaporedno napade alkohol ali amin, da tvori ester oziroma amida.
V prvi vrstici slike je vizualiziran mehanizem, ki sledi reakciji za proizvodnjo estra, druga vrstica. Upoštevajte, da se v obeh reakcijah pojavlja trietilamin klorid, neto3· HCl, iz katerega se obnovi katalizator, da začne drug cikel.
Polimeri
Nukleofilnost trietilamina se uporablja tudi za dodajanje nekaterih polimerov, njihovo ozdravitev in jim daje večje mase. Na primer, je del sinteze polikarziranih smol, poliuretanskih penov in epoksidnih smol.
Kromatografija
Njegova oddaljena amfifičnost in nestanovitnost omogočata uporabo njegovih pridobljenih soli kot reagenti v ionski izmenjalni kromatografiji. Druga implicitna uporaba trietilemina je, da je iz njega mogoče dobiti več soli terciarnih aminov, kot je trietilamin bikarbonat, NHET3HCO3 (ali TEAB).
Vam lahko služi: kalorimetrija: kakšne študije in aplikacijeKomercialni izdelki
Uporablja se kot dodatek pri formulaciji cigaret in tobaka, konzervansov s hrano, tla, aromatiziranja, pesticidov, barvil itd.
Tveganja
Trakovi trietilamina niso le neprijetni, ampak nevarni, saj lahko dražijo nos, grlo in pljuča, da povzročijo pljučni edem ali bronhitis. Prav tako, da so gostejši in težki od zraka, ostajajo na tleh in se premikajo do možnih toplotnih virov, da bi pozneje eksplodirali.
Zabojniki te tekočine morajo biti tako daleč od požara, ker predstavljajo skorajšnjo nevarnost eksplozije.
Poleg tega stik z vrstami ali reagenti, kot so: alkalne kovine, trikloroocetna kislina, nitrati, dušikova kislina (saj bi tvorila nitrozoamine, rakotvorne spojine), močne kisline, perokside in permanganate.
Ne smete se dotikati aluminija, bakra, cinka ali njegovih zlitin, saj jih ima možnost korodiranja.
Glede fizičnega stika lahko povzroči alergije in kožne izpuščaje, če je izpostavljenost akutna. Poleg pljuč lahko vpliva na jetra in ledvice. In glede očesnega stika povzroči draženje, kar bi lahko celo poškodovalo oči, če jih ne zdravimo ali očistimo pravočasno.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Wikipedija. (2019). Trietilamin. Pridobljeno iz: v.Wikipedija.org
- Merck. (2019). Trietilamin. Okreval od: Sigmaaldrich.com
- Nacionalni center za informacije o biotehnologiji. (2019). Trietilamin. Baza podatkov Pubchem. Cid = 8471. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Toksikološko podatkovno omrežje. (s.F.). Trietilamin. Okrevano od: Toxnet.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Ministrstvo za zdravje v New Jerseyju. (2010). Trietilamin. Okreval od: NJ.Gov
- « 10 radovednosti o srednjem veku, ki vas bodo presenetile
- Isoamilico alkoholna struktura, lastnosti, uporabe in tveganja »

