Acetanila (C8H9NO)
- 4502
- 451
- Ricky Dach
Kaj je acetanilid?
The acetanila (C8H9Št) je aromatičen amid, ki prejme več dodatnih imen: N-acetilalamin, n-feenilacetamid in atetanil. Predstavljen je kot trden stranišče v obliki kosmičev, njena kemična narava je amida in kot tak lahko tvori vnetljive pline, ko reagira z močnimi reducirajočimi sredstvi.
Poleg tega gre2Tudi5 Izviriti nitril. Ugotovljeno je bilo, da ima acetanilid analgetično in antipiretično delovanje, leta 1886. Cahn in str. Hepp.
Leta 1899 je bila na trg vnesena acetilsalicilna kislina (aspirin), ki je imela enaka terapevtska dejanja kot acetanilid. Ko je uporaba acetanila povezana s pojavom cianoze pri bolnikih - posledica methemoglobinemije, ki jo povzroča acetanilid - je bila njegova uporaba zavržena.
Nato je bilo ugotovljeno, da analgetično in antipiretično delovanje acetanilida prebivata v presnovku tega tako imenovanega paracetamola (acetoaminofen), ki ni imel svojih strupenih učinkov, kot sta predlagala Axelrod in Brodie.
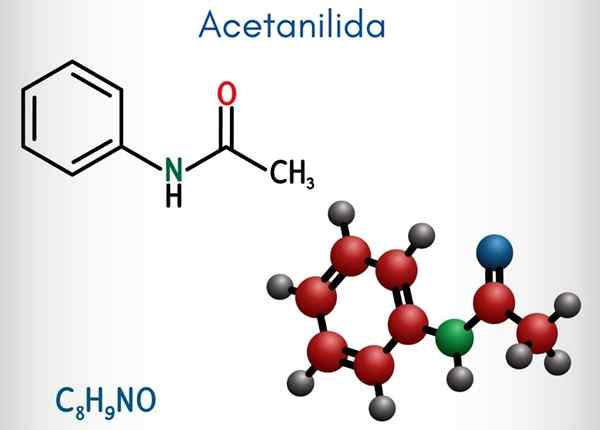
Kemična struktura

Na zgornji sliki je predstavljena kemična struktura acetanilida. Na desni je šesterokotni aromatični obroč benzena (s pikčastimi črtami), levica pa je razlog, da spojina sestavlja aromatična amida: acetamidna skupina (hncoch3).
Acetamidna skupina daje benzenskemu obroču večji polarni značaj; To pomeni, da v molekuli atetanilida ustvarite dipolni trenutek.
Ker? Ker je dušik bolj elektronegativen kot kateri koli od ogljikovih atomov obroča in je povezan tudi z acilno skupino, katere atom ali tudi privlači elektronsko gostoto.
Lahko vam služi: uretan: struktura, lastnosti, pridobivanje, uporabePo drugi strani pa skoraj celotna molekularna struktura acetanilida počiva na isti ravnini zaradi hibridizacije SP2 atomov, ki ga sestavljajo.
Obstaja izjema, povezana s tistimi iz skupine -ch3, katerih vodikovi atomi sestavljajo točke tetraedra (bele sfere levega konca puščajo ravnino).
Resonančne strukture in medmolekularne interakcije
Samotni navor brez skupne rabe v atomu N kroži skozi π sistem aromatičnega obroča, ki izvira iz več resonančnih struktur. Vendar se ena od teh struktur konča z negativno obremenitvijo v atomu O (več elektronegativa) in pozitivno obremenitvijo v atomu N.
Tako obstajajo resonančne strukture, kjer se v obroču premika negativna obremenitev, in drugo, kjer prebiva v atomu Of. Zaradi te "elektronske asimetrije"-ki izvira iz roke molekularne asimetrije-, acetanilid medmolekularno deluje s sili dipole-dipolo.
Vendar so interakcije med vodikovimi mostovi (N-H-O-…) med dvema molekulama acetanilida pravzaprav prevladujoča sila v njegovi kristalni strukturi.
Na ta način so acetanilidni kristali sestavljeni iz celic ortrormbičnih enot osmih molekul, usmerjenih z oblikami "ravnih trakov" s svojimi vodikovimi mostovi.
Zgoraj lahko vizualiziramo, če je molekula acetanilida nameščena na drugo, vzporedno. Torej, kot Hncoch skupine3 Space se prekrivajo, tvorijo vodikove mostove.
Poleg tega lahko med tema dvema molekulama tudi "ukradejo" tretjino, vendar z aromatičnim obročem kaže na nasprotno stran.
Vam lahko služi: bromotimol modroKemične lastnosti acetanila
 AppertID videz
AppertID videz Molekularna teža
135,166 g/mol.
Kemični opis
Bela ali sivkasto trdna. Tvorijo svetlo bele kosmiče ali kristalno beli prah.
Vonj
Stranišče.
Okus
Rahlo začinjen.
Vrelišče
304 ° C do 760 mmHg (579 ° F pri 760 mmHg).
Tališče
114,3 ° C (237,7 ° F).
Bliskavica ali vnetljivost
169 ° C (337 ° F). Meritev, narejena v odprtem steklu.
Gostota
1,219 mg/ml pri 15 ° C (1,219 mg/ml pri 59 ° F)
Gostota hlapov
4.65 z zračnim razmerjem.
Parni tlak
1 mmHg pri 237 ° F, 1,22 × 10-3 mmHg pri 25 ° C, 2a pri 20 ° C.
Stabilnost
Trpi kemični reprezenlo, ko je izpostavljen ultravijolični svetlobi. Kako se spreminja struktura? Acetilna skupina tvori nove povezave v obroču v položajih Ortho in za. Poleg tega je stabilen v zraku in nezdružljiv z močnimi oksidacijskimi sredstvi, kavstiko in alkaliji.
Nestanovitnost
Občutno nestanovitno pri 95 ° C.
Samosmernost
1004 ° F.
Razgradnja
Ob segrevanju se razpade in oddaja zelo strupeni dim.
ph
5 - 7 (10 g/l h2Ali 25 ° C)
Topnost
- V vodi: 6,93 × 103 mg/ml pri 25 ° C.
- 1 g topnosti acetanilida v različnih tekočinah: v 3,4 ml alkohola, 20 ml vrele vode, 3 ml metanola, 4 ml acetona, 0,6 ml vrelega alkohola, 3,7 ml kloroform, 5 ml Gliecerola, 8 ml Dioxan, 47 ml benzena in 18 etra. Kloralni hidrat poveča topnost acetanilida v vodi.
Sinteza
Sintetizira se z reakcijo ocetnega anhidrida z acetanilidom. Ta reakcija se pojavlja v številnih besedilih organske kemije (Vogel, 1959):
C6H5Nh2 + (Pogl3Co)2O => c6H5NHCOCH3 + Pogl3COOH
Lahko vam služi: borax: zgodovina, struktura, lastnosti, uporabe, sinteza, tveganjaPrijave
- To je zaviralno sredstvo procesa razgradnje vodikovega peroksida (vodikov peroksid).
- Stabilizirajte lastine celuloznega estra.
- Posreduje kot posrednik pri pospeševanju proizvodnje gume. Prav tako je posrednik v sintezi nekaterih barvil in kamfora.
- Deluje kot predhodnik sinteze penicilina.
- Uporablja se pri proizvodnji 4-acetamidefonilzenskega klorida. Acetanila reagira s klorosulfonsko kislino (HSO3Cl), s čimer ustvarja klorid 4-aminosulfonilbenzena. To reagira z amonijem ali primarnim organskim aminom, da tvori sulfonamide.
- Uporabljali so ga eksperimentalno v devetnajstem stoletju pri razvoju fotografije.
- Acetanila se uporablja kot označevalec elektroosmotskih tokov (EOF) v kapilarni elektroforezi za preučevanje povezave med zdravili in beljakovinami.
- Pred kratkim se je 1- (ω-fenoksialkiluracilo) pridružil inhibiciji v poskusih inhibicije poskusov inhibicije virusa hepatitisa C. Acetanila se pridruži položaju 3 pirimidinskega obroča.
- Eksperimentalni rezultati kažejo na zmanjšanje razmnoževanja virusnega genoma, ne glede na virusni genotip.
- Preden je identificiral toksičnost acetanilida, je bil iz leta 1886 uporabljen kot analgetik in antipiretik. Nato so ga Grün uporabili pri zdravljenju kroničnega in akutnega bronhitisa (1891).