50 primerov kislin in baz

- 2102
- 159
- Dexter Koch
Obstaja na stotine Primeri kislin in baz To je mogoče najti v vseh vejah kemije, vendar se kot celota ločita na dve veliki družini: anorganski in organski. Anorganske kisline so običajno znane kot mineralne kisline, za katere je značilno, da so še posebej močne v primerjavi z organskimi.
Kisline in baze se razumejo kot snovi, ki imajo domiselne okuse oziroma saponáceos. Oba sta korozivna, čeprav se beseda "kavstična" običajno uporablja za močne baze. Če povzamejo poročila: kurijo in vodijo kožo, če se jo dotaknejo. Njegove značilnosti v medijih v topilih so v zgodovini načrtovale vrsto definicij.
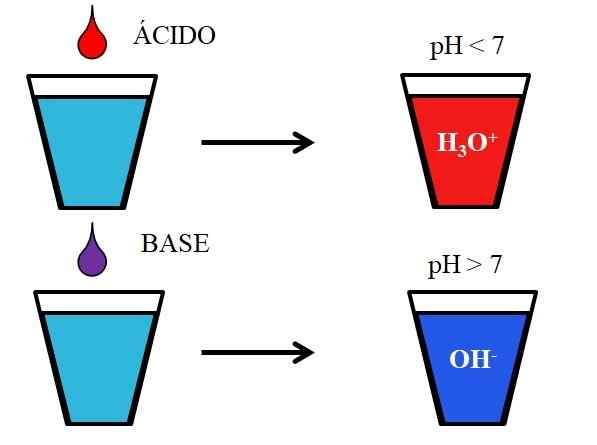 Obnašanje kislin in baz, ko se raztopi v vodi. Vir: Gabriel Bolívar.
Obnašanje kislin in baz, ko se raztopi v vodi. Vir: Gabriel Bolívar. Spodnja slika prikazuje generično obnašanje kislin in baz, ko jih dodamo ali raztopimo v kozarcu z vodo. Kisline proizvajajo raztopine z vrednostmi pH pod 7 zaradi hidroniosnih ionov, h3Tudi+; Medtem ko baze proizvajajo raztopine s pH nad 7 zaradi hidroksilnih ionov (ali oksidrila), OH-.
Če v kozarec dodamo klorovodikovo kislino, HCl (rdeča kapljica)3Tudi+ in Cl- hidrirana. Po drugi strani pa, če poskus ponovimo z natrijevim hidroksidom, NaOH (vijolična kapljica), bomo imeli OH ione- in na+.
[TOC]
Definicije

Značilnosti, ki jih vse bolj preučujemo in razumljene, kislin in baz so postavljale več kot eno definicijo za te kemične spojine. Med temi definicijami imamo Arrhenius, BRONSTED-LOWRY in končno Lewis. Preden navajamo primere, je treba to jasno.
Arrenius
Kisline in baze so po Arreniusu tiste, ki so se raztopile v vodi, ki proizvajajo H ione3Tudi+ ali oh-, oziroma. To pomeni, da slika že predstavlja to definicijo. Vendar sama po sebi prezira nekaj prešibkih kislin ali baz, da bi ustvarila takšne ione. Tu vstopi v definicija Bronsted-Lowry.
Vam lahko služi: kisline: značilnosti in primeriBRONSTED-LOWRY
BRONSTED-LOWRY KISLINE so tiste, ki lahko podarijo ione H+, In baze so tiste, ki sprejemajo te h+. Če kislina darova zelo enostavno+, To pomeni, da je močna kislina. Enako velja za baze, a sprejemanje h+.
Tako imamo močne ali šibke kisline in baze, njihove sile pa se merijo v različnih topilih; zlasti v vodi, od katerih so vzpostavljene znane pH enote (od 0 do 14).
Zato bo močna kislina popolnoma podarila h h+ v vodo v reakciji tipa:
Ha + h2O => a- + H3Tudi+
Kje- To je konjugirana baza ha. Od tu prihaja torej h3Tudi+ prisoten v kozarcu s kislinsko raztopino.
Medtem bo šibka baza B nezaščitena voda, da bi pridobila svoj H+:
B + h2Ali HB + OH-
Kjer je Hb konjugirana kislina B. To je primer amoniaka, NH3:
Nh3 + H2Ali nh4+ + Oh-
Zelo močna osnova lahko neposredno daje OH ione- ni treba reagirati z vodo; Kot pri NAOH.
Lewis
Končno so Lewisove kisline tiste, ki zmagajo ali sprejemajo elektrone, Lewisove baze pa so tiste, ki darovajo ali izgubijo elektrone.
Na primer, BRONSTED-LOWRY NH baza3 Je tudi baza Lewis, saj dušikov atom sprejme h+ Z darovanjem tega njihovega par prostih elektronov (h3N: h+). Zato se tri definicije ne strinjajo med seboj, vendar se prepletajo in pomagajo preučiti kislost in bazičnost v širšem spektru kemijskih spojin.
Vam lahko služi: nikelj: zgodovina, lastnosti, struktura, uporabe, tveganjaPrimeri kislin
Po razjasnitvi definicij bo spodaj omenjena vrsta kislin z ustreznimi formulami in imeni:
-HF: fluorhidrična kislina
-HBR: Bromhidrična kislina
-Živjo: jodhidric kislina
-H2S: sulfhidrična kislina
-H2SE: Seleenhidric kislina
-H2TE: Telurhidrična kislina
To so binarne kisline, imenovane tudi hidraceidi, ki spadajo v prej omenjeno klorovodikovo kislino, HCl.
-Hno3: dušikova kislina
-Hno2: Dušikova kislina
-Hno: hiponitronska kislina
-H2Co3: Ogljikova kislina
-H2Co2: karbonoso kislina, ki je pravzaprav bolj znana po imenu mravljične kisline, hcooh, najpreprostejša organska kislina od vseh
-H3Po4: fosforna kislina
-H3Po3 ali h2[HPO3]: fosforna kislina, s H-p vezjo
-H3Po2 ali h [h2Po2]: hipofosferska kislina, z dvema H-P vezima
-H2SW4: žveplova kislina
-H2SW3: Žveplova kislina
-H2S2Tudi7: disulfrinska kislina
-Hio4: periódijska kislina
-Hio3: Yodijeva kislina
-Hio2: jodozna kislina
-Hio: hipojodoso kislina
-H2Cro4: kromova kislina
-Hmno4: Manganska kislina
-Pogl3COOH: ocetna kislina (kis)
-Pogl3SW3H: metanosulfonska kislina
Vse te kisline, razen za formalno in zadnja dva, so znane kot oxácidos ali Ternarne kisline.
Drugi:
-Alcl3: Aluminijev klorid
-FECL3: železov klorid
-Bf3: Boro Trifluoruro
-Kovinski kationi, raztopljeni v vodi
-Karbokacije
-H (chbenajstClenajst): Super kislina karborano
- Fso3H: fluorosulfonska kislina
- Hsbf6: Fluoroantimonska kislina
- Fso3H · SBF5: Čarobna kislina
Zadnji štirje primeri predstavljajo strašljive super kisline; spojine, ki lahko razpadejo skoraj vsak material s komaj dotikanjem. Alcl3 To je primer Lewisove kisline, saj je aluminijasti kovinski center sposoben sprejeti elektrone zaradi elektronskega pomanjkanja (ne dokonča svojega okteta Valencia).
Vam lahko služi: živosrebrni hidroksid: struktura, lastnosti, uporabe, tveganjaPrimeri baz
Med anorganskimi bazami imamo kovinske hidrokside, kot so natrijev hidroksid, in nekaj molekulskih hidurnov, kot je že navajan amonijak. Tu so še drugi primeri baz:
-Koh: kalijev hidroksid
-Lioh: litijev hidroksid
-RBOH: Rubidio hidroksid
-CSOH: Cezijev hidroksid
-Froh: Francio hidroksid
-Biti (oh)2: Beryl hidroksid
-MG (OH)2: magnezijev hidroksid
-CA (OH)2: Kalcijev hidroksid
-Sr (oh)2: Stroncijev hidroksid
-Ba (oh)2: barijev hidroksid
-Ra (oh)2: radijski hidroksid
-Vera (OH)2: železov hidroksid
-Vera (OH)3: železov hidroksid
-Al (OH)3: Aluminijev hidroksid
-PB (OH)4: Plúmbic hidroksid
-Zn (OH)2: cink hidroksid
-CD (OH)2: kadmijev hidroksid
-Cu (OH)2: CuPric hidroksid
-Ti (oh)4: Titanski hidroksid
-Ph3: fosfin
-Pepel3: Arsina
-Nanh2: Natrij Amiduro
- C5H5N: Piridin
-(Pogl3) N: trimetilamin
- C6H5Nh2: Fenilamin ali anilin
-Ne: natrijev hidrid
-KH: kalijev hidrid
-Karbanioni
-Li3N: litijev nitrid
-Alcoksidi
-[(Pogl3)2Pog2NLI: diizopropilamid litija
-Dietinilbenzen anion: c6H4C42- (do zdaj najmočnejša baza))
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Naomi Hennah. (10. oktober 2018). Kako naučiti kislin, baz in soli. Okreval od: edu.RSC.org
- Čelada, Anne Marie, ph.D. (31. avgust 2019). Formule skupnih kislin in baz. Okreval od: Thoughtco.com
- David Wood. (2019). Primerjajte skupne kisline in baze. Študij. Okrevano od: študij.com
- Ross Pomeroy. (23. avgust 2013). Najmočnejše kisline na svetu: kot ogenj in led. Okrevano od: Realclearscience.com
- Wikipedija. (2019). Diethynylbenzene Dianion. Pridobljeno iz: v.Wikipedija.org
- « Premer simboli in formule, kako ga odpeljati, obod
- Ekofiziologija Katere študije in aplikacije pri živalih in zelenjavi »

