Yoduro, vendar značilnosti, struktura, funkcije
- 3365
- 965
- Lee Farrell
The Yoduro peroksidaza ali tiroidna peroksidaza (TPO) je hemo-glikoprotein, ki pripada družini peroksidaz sesalcev (kot so mieloperoksidaza, laktoperoksidaza in drugi), ki sodeluje na poti sinteze ščitničnega hormona.
Njegova glavna funkcija je "jodinacija" tirozinskih odpadkov v tioglobulinu in tvorba 3-3-5-triiodotironina (T3) in tiroksina (T4) skozi "sklopko" reakcijo intramolekularnih jodiziranih tirozinov.
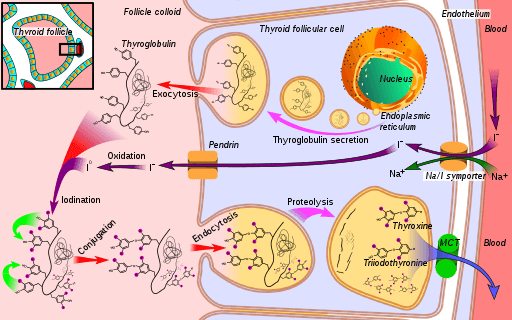
 Shema biosintetske poti ščitničnega hormona, kjer jodidna peroksidaza (pri oksidaciji jodida do joda) (vir: Mikael Häggström [CC0] prek Wikimedia Commons)
Shema biosintetske poti ščitničnega hormona, kjer jodidna peroksidaza (pri oksidaciji jodida do joda) (vir: Mikael Häggström [CC0] prek Wikimedia Commons) Triiodinin in tiroksin sta dva hormona, ki jih proizvaja ščitnica, ki imata bistvene funkcije pri razvoju, diferenciaciji in presnovi sesalcev. Njen mehanizem delovanja je odvisen od interakcije njegovih jedrskih receptorjev s specifičnimi genskimi zaporedji njegovih belih genov.
Obstoj encima Yoduro peroksidaze so v šestdesetih letih prejšnjega stoletja potrdili različni avtorji in trenutno je bil dosežen velik napredek glede določitve njegove strukture, njegovih funkcij in značilnosti gena, ki ga kodira v različnih organizmih.
V večini literature, povezane s tem encimom, je to znano kot mikrosomalni "avtoantigen" in je povezano z nekaterimi avtoimunskimi boleznimi tiroidov.
Zahvaljujoč imunogenim značilnostim je ta encim bela ali ciljna molekula.
[TOC]
Značilnosti
Jodid peroksidaze je kodiran z gen, ki se nahaja na kromosomu 2 ljudi, ki meri več kot 150 kpb in je sestavljen iz 17 eksonov in 16 intronov.
Ta transmembraal protein z enim samim segmentom, potopljenim v membrano, je tesno povezan z mieloperoksidazo, s katero si deli več kot 40% podobnosti aminokislinskega zaporedja.
Vam lahko služi: acilgliceridi: značilnosti, struktura, vrste, funkcijeNjegova sinteza se pojavi v poliribosomih (nabor ribosomov, ki so odgovorni za prevod istega proteina) in se nato vstavi v endoplazemsko retikulumsko membrano, kjer gre skozi proces glikozilacije.
Ko je sintetiziran in glikoziliran, se peroksidazni jodid prevaža na apikalni pol vlečenja (ščitnice ali ščitnice), kjer lahko svoje katalitično središče izpostavi proti folikularnemu lumen ščitnice.
Regulacija izražanja
Izraz kodirnega gena ščitnice ali jodidne peroksidaze nadzirajo specifični faktorji transkripcije ščitnice, kot so TTF-1, TTF-2 in PAX-8.
Genetski elementi, ki omogočajo povečanje ali izboljšanje izražanja tega gena pri ljudeh, so bili opisani v regijah, ki obarvajo konec 5 'istega, običajno med prvimi 140 baznimi pari te regije "Flannquante".
Obstajajo tudi elementi, ki zatirajo ali zmanjšujejo izražanje tega proteina, vendar so za razliko od "potenciranja" opisani nižje od genskega zaporedja.
Večina regulacije genetske ekspresije jodidne peroksidaze se pojavi na tkivno specifičen način, kar je odvisno od delovanja elementov Unije DNK, ki delujejo v Cis, kot so transkripcijski faktorji TTF-1 in drugi.
Struktura
Ta protein z encimsko aktivnostjo ima približno 933 aminokislinskih odpadkov in zunajcelični C-terminalni konec 197 aminokislin, ki izvirajo iz izražanja drugih genskih modulov, ki kodirajo za druge glikoproteine.
Njegova molekulska teža je približno 110 kDa in je del glikozilirane transmembranalne beljakovinske skupine tipa 1.
Lahko vam služi: žleze: vrste, funkcija, vnetje in bolezniStruktura tega proteina ima vsaj disulfidni most v zunajceličnem območju, ki tvori značilno zaprto zanko, ki je izpostavljena na površini tirocitov.
Funkcije
Glavna fiziološka funkcija peroksidaznega jodida je povezana z njeno udeležbo v sintezi ščitničnega hormona, kjer katalizira "jodacijo" tirozin odpadkov monoyodotirozina (MIT) in diosirozina (DIT), poleg spajanja iodirozina ostanki v tioglobulinu.
Kakšna je sinteza ščitničnega hormona?
Da bi razumeli funkcijo encima ščitnice peroksidaze, je treba upoštevati korake hormonske sinteze, kjer sodeluje:
1-vrsto s prevozom jodida do ščitnice in nadaljuje z
2-generacija oksidacijskega sredstva, kot je vodikov peroksid (H2O2)
3-zadaj je sintetiziran sprejemajoči se protein, tioglobulin
4-letniku je oksidiran v stanje starejše valencije in po
5-Le-
6-in tioglobulin, jodothye (vrsta ščitničnih hormonov) nastane zaradi riodotske sklopke odpadkov
7-Thioglobulin je shranjen in pljuvan
8-jodirosinas jodirosinas odstranimo in končno,
9-tiroksin se sprosti in triiodothyron proti krvi; Ti hormoni izvajajo svoje učinke z interakcijo s svojimi specifičnimi receptorji, ki se nahajajo v jedrski membrani in so sposobni interakciji z zaporedji belih DNK, ki delujejo kot transkripcijski faktorji.
Kot je mogoče odmakniti od poznavanja funkcij obeh hormonov, katerih sinteza sodeluje (T3 in T4), ima peroksidazni jodid pomembne posledice na fiziološki ravni.
Pomanjkanje obeh hormonov med človeškim razvojem povzroča napake v rasti in duševni zaostalost, pa tudi presnovna neravnovesja v življenju odraslih.
Vam lahko služi: holoencim: značilnosti, funkcije in primeriSorodne bolezni
Peroksidazni jodid je eden glavnih avtoantigenov ščitnice pri ljudeh in je povezan s citotoksičnostjo, ki jo posreduje sistem komplementa. Njegova funkcija kot avtoantigen izstopa pri bolnikih s ščitničnimi avtoimunskimi boleznimi.
Na primer, bolezen GOTA je posledica pomanjkanja vsebnosti joda med hormonsko sintezo v ščitnici, ki je bila povezana s proizvodom pomanjkanja jodinacije tiroglobulina nekaterih napak pri določenih napakah v peroksidazni peroksidazi.
Za nekatere karcinome je značilno, da imajo spremenjene funkcije peroksidaznega jodida, to je, da so ravni aktivnosti tega encima bistveno nižje kot pri bolnikih, ki niso ravniki.
Vendar so študije potrdile, da gre za izjemno spremenljivo značilnost, ki ni odvisna samo od pacienta, ampak od vrste raka in prizadetih regij.
Reference
- Degroot, l. J., & Niepomniszcze, h. (1977). Biosinteza ščitničnega hormona: osnovni in klinični vidiki. Napredek v endokrinologiji in presnovi, 26(6), 665–718.
- Fraga, str., & Nataf, b. M. (1976). Aktivnost človeške tiroidne peroksidaze pri benignih in malignih motnjah ščitnice. Endokrina družba, Štiri. Pet(5), 1089-1096.
- Kimura, s., & Ikeda-saito, m. (1988). Človeški mieloperoksidae in tiroidna peroksidaza, dva encima z ločenimi in različnimi fiziološkimi funkcijami, sta evolucijsko povezana člana iste genske genske družine. Beljakovine: struktura, funkcija in bioinformatika, 3, 113-120.
- Nagasaka, a., Hidaka, h., & Ishizuki in. (1975). Študije o človeški jodidni peroksidazi: njena aktivnost pri različnih motnjah ščitnice. Klinično kemično dejanje, 62, 1-4.
- Ruf, J., & Carayon, str. (2006). Strukturni in funkcionalni vidiki ščitnice peroksidaze. Arhiv biokemije in biofizike, 445, 269-277.
- Ruf, J., Toubert, m., Czarnocka, b., Durand-Gorde, m., Ferrand, m., & Carayon, str. (2015). Razmerje med imunološko strukturo in biokemijskimi lastnostmi človeške tiroidne peroksidaze. Endokrine ocene, 125(3), 1211-1218.
- Tauron, a. (1999). Molekularna evolucija ščitnične peroksidaze. Biochimie, 81, 557-562.
- Zhang, J., & Lazar, m. Do. (2000). Mehanizem delovanja ščitničnih hormonov. Annu. Rev. Fiziol., 62(1), 439–466.

