Zgodovinski jod, lastnosti, struktura, pridobivanje, tveganja, uporabe

- 3726
- 372
- Don Nitzsche
On jod Gre. V bistvu je dobro znan element na priljubljeni ravni, od jodirane vode, do tirozinskega hormona.
V trdnem stanju je jod temno siv s kovinskim sijajem (spodnja slika), ki lahko sublimira, da ustvari vijolično paro, ki pri kondenzaciji na hladni površini pusti temne ostanke. Številni in privlačni so bili eksperimenti za prikaz teh značilnosti.
 Robustni kristali joda. Vir: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Robustni kristali joda. Vir: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Ta element je v letu 1811 prvič izoliral Bernard Curtois, medtem ko je pridobil spojine, ki so služile kot surovina za izdelavo soline. Vendar Curtois ni identificiral joda kot elementa, zasluge, ki sta si jo delila Joseph Gay-Lussac in Humphry Davy. Gay-Lussac je element identificiral kot "iode", izraz, ki je izhajal iz grške besede "ioides", s katero je bila označena vijolična barva.
Elementarni jod, tako kot drugi halogeni, je diatomska molekula, ki jo tvorita dva atoma joda, združena s kovalentno vezjo. Van der Waalsova interakcija med molekulami joda je najmočnejša med halogeni. To pojasnjuje, zakaj je jod halogen z najvišjimi točkami taljenja in vrelišča. Poleg tega je najmanj reagent halogenov in tisti z manj elektronegativnosti.
Jod je bistven element, ki zahteva zaužitje, saj je potreben za rast telesa; možgani in duševni razvoj; Presnova na splošno itd., Priporočanje dnevnega vnosa 110 µg/dan.
Pomanjkanje joda v človekovem fetalnem stanju je povezano z pojavom kretenizma, stanja, za katerega je značilna upočasnjena rast telesa; kot tudi nezadostni duševni in intelektualni razvoj, strabizem itd.
Medtem je pomanjkanje joda v kateri koli starosti posameznika povezano z pojavom goiterja, za katerega je značilna hipertrofija ščitnice. Goiter je endemična bolezen, saj je omejena na določena geografska območja z lastnimi lastnostmi hrane.
[TOC]
Zgodovina
Odkritje
Joda je v letu 1811 odkril francoski kemik Bernard Curtois, medtem ko je sodeloval z očetom v proizvodnji Salitre, ki zahteva zanj natrijevega karbonata.
Ta spojina je bila izolirana iz morskih alg, ki so se zbrale na obali Normandije in Bretanije. V ta namen so alge zgorele in pepela smo sprali z vodo, ki so uničili nastale odpadke z dodatkom žveplove kisline.
Nekoč, morda zaradi naključne napake, je Curtois dodal presežek žveplove kisline in oblikovala je vijolična para, ki je kristalizirala na hladnih površinah, ki se odlaga kot temne kristale. Curtois je sumil, da je v prisotnosti novega elementa in ga je poimenoval "snov X".
Curtois je odkril, da je ta snov, ko je bila pomešana z amonijakom, tvorila rjavo trdno snov (dušikov triakuro).
Vendar je imel Curtois omejitve za nadaljevanje raziskovanja in se je odločil, da bo znake svoje snovi dostavil Charlesu Desormesu, Nicolasu Clémentu, Joseph Gay-Lussac in André-Marie Ampère.
Pojav imena
Novembra 1813 sta Desormes in Clément objavila odkritje Curtoisa. Decembra istega leta je Gay-Lussac dejal, da je nova snov lahko nov element, ki predlaga ime "iode" iz grške besede "ioides", imenovano za vijolično.
Sir Humphry Davy, ki je delež vzorca prejel Ampère, ki ga je Curtois dostavil, je poskusil z vzorcem in opazil podobnost s klorom. Decembra 1813 je Royal Society of London sodeloval pri identifikaciji novega elementa.
Čeprav je argument med Gay-Lussac in Davyjem glede identifikacije joda nastal, sta oba prepoznala, da je Curtois prvi izoliral. Leta 1839 finale Curtois.
Zgodovinska uporaba
Leta 1839 je Louis Daguerre jodu dal svojo prvo komercialno uporabo z izumom metode za izdelavo fotografskih slik, imenovanih daguerreotipi, v tankih listih kovine.
Leta 1905 je ameriški patolog David Marine raziskal pomanjkanje joda pri nekaterih boleznih in priporočil njegov vnos.
Fizikalne in kemijske lastnosti
Videz
 Sublimacija jodnih kristalov. Vir: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Sublimacija jodnih kristalov. Vir: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Temno siv kovinski lesk. Ko sublimira svoje hlape, so vijolična obarvanost (nadrejena slika).
Standardna atomska teža
126.904 u
Atomsko število (z)
53
Tališče
113,7 ° C
Vrelišče
184,3 ° C
Gostota
Temperatura okolice: 4.933 g/cm3
Topnost
V vodi se raztopi, da povzroči rjave raztopine koncentracije od 0,03% do 20 ° C.
Ta topnost se znatno poveča, če obstajajo prej raztopljeni jodidni ioni, saj se vzpostavi ravnovesje med I- in jaz2 Oblikovati anionske vrste i3-, ki je rešena bolje kot jod.
V organskih topilih, kot so kloroform, ogljikov tetraklorid in ogljikov disulfid, se jod raztopi. Raztopi se tudi v dušikovih spojinah, kot so piridin, kinolin in amonijak, da tvori rjavo raztopino, spet.
Razlika v obarvanjih je v tem, da se jod raztopi kot solvatene molekule i2, ali kot komplekse prenosa obremenitve; Slednji se pojavijo, ko se ukvarjajo.
Vam lahko služi: natrijev sulfid (NA2)Vonj
Hektar, dražilni in značilni. Prag vonja: 90 mg/m3 in dražilni prag vonja: 20 mg/m3.
Koeficient oktanola/vode
Dnevnik p = 2,49
Razgradnja
Ko se segreje na razgradnjo, oddaja vodikov jodidni dim in več jodidnih spojin.
Goo
2,27 CP pri 116 ° C
Trojna točka
386,65 K in 121 kPa
Kritična točka
819 K in 11,7 MPA
Fuzijska toplota
15,52 kJ/mol
Toplota za uparjanje
41,57 kJ/mol
Molarna kalorična sposobnost
54,44 j/(mol · k)
Parni tlak
Jod ima zmerni tlak s paro in ko se odpre posoda, ki vsebuje vsebovanje, se počasi sublimira na vijolično paro, draži za oči, nos in grlo.
Oksidacijske številke
Oksidacijske številke za jod so: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) in +7 (i7+). V vseh jodidnih soli, kot v primeru KI, jod sreča oksidacijsko število -1, ker imamo anion I-.
Jod pridobi pozitivne oksidacijske številke v kombinaciji z več elektronegativnimi elementi kot on; Na primer v njihovih oksidih (i2Tudi5 in jaz4Tudi9) ali interhalogenirane spojine (I-F, I-CL in I-BR).
Elektronegativnost
2.66 na lestvici Pauling
Ionizacijska energija
Prvi: 1.008.4 kJ/mol
Drugi: 1.845 kJ/mol
Tretjič: 3.180 kJ/mol
Toplotna prevodnost
0,449 w/(m · k)
Električna upornost
1,39 · 107 Ω · m do 0 ° C
Magnetni vrstni red
Diamagnet
Reaktivnost
Jod je kombiniran z večino kovin, da tvori jodide, in tudi z nemetalnimi elementi, kot so fosfor in drugi halogeni. Jodidni ion je močno reducirajoče sredstvo, ki spontano sprosti elektron. Oksidacija jodida povzroči rjavkasto barvilo joda.
Jod je v nasprotju z jodidom šibko oksidacijsko sredstvo; šibkejši od broma, klora in fluorida.
Jod z oksidacijsko številko +1 lahko kombiniramo z drugimi halogeni z oksidacijsko številko -1, da nastane halogenide joda; Na primer: jodni bromid. Prav tako je v kombinaciji z vodikom, da povzroči vodikov jodid, ki se po raztapljanju v vodi imenuje iarhidna kislina.
Yodhorrinska kislina je zelo močna kislina, ki lahko tvori jodide z reakcijo s kovinami ali njihovimi oksidi, hidroksidi in karbonatom. Jod ima stanje oksidacije +5 v jodijevi kislini (HIO3), ki je dehidrirana za proizvodnjo jod pentoksida (i2Tudi5).
Elektronska struktura in konfiguracija
- Atom joda in njihove povezave
 Jodna diatomična molekula. Vir: Benjah-BMM27 prek Wikipedije.
Jodna diatomična molekula. Vir: Benjah-BMM27 prek Wikipedije. Jod v svojem bazalnem stanju je sestavljen iz atoma, ki ima sedem elektronov Valencije, le eden od tega, da lahko dokonča svoj oktet in postane izolektronski z plemenitim ksenonskim plinom. Teh sedem elektronov je razporejenih v svojih 5S in 5p orbitalov v skladu z njihovo elektronsko konfiguracijo:
[KR] 4d10 5s2 5 str5
Zato atomi I kažejo močno težnjo po kovalentno povezavo, tako da ima vsak posamezno osem elektronov v svoji najbolj oddaljeni plasti. Tako se dva atoma I približata in tvorita povezavo I-I, ki definira diatomsko molekulo I2 (Vrhunska slika); Molekularna enota joda v treh fizičnih stanjih v normalnih pogojih.
Na sliki opazimo molekulo I2 predstavljen z modelom vesoljskega polnjenja. Ne samo, da gre za diatomsko molekulo, ampak tudi homonuklearna in apolarna; Torej njene medmolekularne interakcije (i2 - Yo2) Urejajo jih londonske disperzijske sile, ki so neposredno sorazmerne z njihovo molekulsko maso in velikostjo atoma.
Ta povezava I-I pa je v primerjavi z drugimi halogeni šibkejša (F-F, CL-CL in BR-BR). To je teoretično posledica slabega prekrivanja njegovega SPO3.
- Kristali
Molekularna masa i2 Omogoča, da so njene disperzivne sile dovolj usmerjene in močne, da vzpostavijo ortrorombično steklo pri tlaku v okolju. Njegova visoka vsebnost elektronov omogoča svetlobo, ki spodbuja energijsko prehodno simfine, ki proizvajajo jodne kristale.
Ko pa jod sublimate, imajo njeni hlapi vijolična obarvanost. To že kaže na bolj specifični prehod znotraj molekulskih orbitalov I2 (Tisti z večjo energijo ali antienlace).
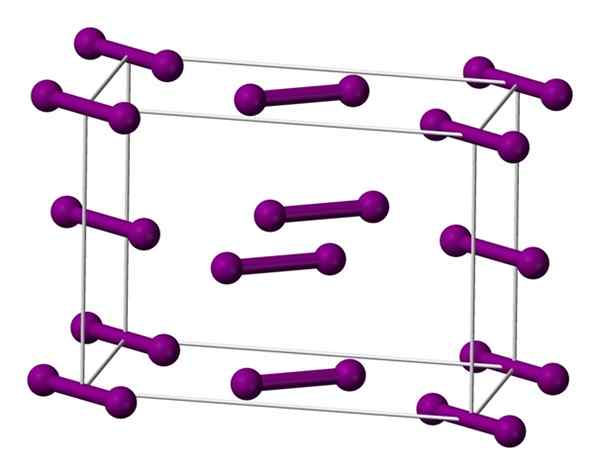 Enotna ortorrambična celica, osredotočena na dno za kristal joda. Vir: Benjah-BMM27 [javna domena].
Enotna ortorrambična celica, osredotočena na dno za kristal joda. Vir: Benjah-BMM27 [javna domena]. Molekule, ki so prikazane zgoraj2, predstavljen z modelom kroglic in palic, naročenih znotraj Ortorrombične celice.
Opazimo, da obstajata dve plasti: spodaj s petimi molekulami in medij s štirimi. Upoštevajte, da se na dnu celice nahaja molekula joda. Kristal je občasno zgrajen te plasti v treh dimenzijah.
Če obiščete smer, vzporedno s povezavami I-I, se ugotovi, da se jodne orbitale prekrivajo, da ustvarijo gonilni pas, ki se na ta element vrne v polprevodnik; Vendar njegova sposobnost vodenja električne energije izgine, če sledi smer pravokotna na plasti.
Razdalje povezav
Zdi se, da je povezava I-I zavlečena; In v resnici je to, ker se dolžina njegove povezave povečuje od 22. ure (plinasto stanje), 272 pm (trdno stanje).
To je lahko posledica dejstva, da v plin molekule i2 So zelo oddaljeni, njihove medmolekularne sile so skoraj zanemarljive; Medtem ko so v trdni trdni snovi, te sile (i-i-i-i) postanejo otipljive, privabljajo jodne atome dveh sosednjih molekul proti sebi in glede na medmolekularno razdaljo (ali interatomsko, sicer videti).
Lahko vam služi: odnos kemije z drugimi znanostmiPotem, ko sublimalno jodno steklo, se I-I vezi v plinski fazi sklene, saj sosednje molekule ne izvajajo več iste sile privlačnosti (disperzijske) nad okolico. In tudi logično, razdalja i2 - Yo2 poveča.
- Faze
Zgoraj je bilo omenjeno, da je povezava I-I šibkejša v primerjavi z drugimi halogeni. V plinski fazi pri temperaturi 575 ° C, 1% molekul I2 Se razpadajo v posameznika in atome. Obstaja toliko toplotne energije, da sta ločena samo dva in re -join in tako naprej.
Podobno se lahko zgodi to prekinitev povezave, če se uporabijo ogromni pritiski na kristale joda. Ko ga preveč stisnete (pod pritiskom na stotine tisočkrat višji od atmosferske), molekule i2 Preurejeni so kot monoatomska faza I, nato pa se reče, da jod kaže kovinske značilnosti.
Vendar obstajajo druge kristalne faze, kot so: Orhrome.
Kje je in dobimo
Jod ima delež teže, glede na zemeljsko skorjo, 0,46 ppm, v njem pa zaseda mesto 61. Yoduro minerale je malo in nahajališča joda, ki jih komercialno izkoriščajo, so Yodatos.
Jodni minerali najdejo v magnetnih kamninah s koncentracijo 0,02 mg/kg pri 1,2 mg/kg in v magmatičnih kamninah s koncentracijo 0,02 mg pri 1,9 mg/kg. Najdemo ga tudi v lutiti Kimmeridge s koncentracijo 17 mg/kg teže.
Poleg tega jodni minerali najdemo v fosfatnih kamninah s koncentracijo med 0,8 in 130 mg/kg. Morska voda ima koncentracijo joda, ki se giblje od 0,1 do 18 µg/L. Alge, gobice in morske ostrige so bile prej glavni viri joda.
Vendar pa so glavni viri kaliche, nahajališča natrijevega nitrata v puščavi Atacama (Čile) in salmuelas, predvsem tistih japonskega plinskega polja v Minami Kanto, vzhodno od Tokia, in porečje Anadarko v Oklahomi (ZDA ).
Kaliche
Jod se ekstrahira iz jodinus caliche in se zdravi z natrijevim bisulfitom, da ga zmanjša na jodid. Nato raztopina reagira z na novo ekstrahiranim Yodatojem, da olajša svojo filtracijo. Kaliche je bil glavni vir joda v devetnajstem in zgodnjem dvajsetem stoletju.
Slanica
Po njegovem čiščenju se slanica obdela z žveplovo kislino, ki proizvaja jodid.
Ta raztopina jodida se nato reagira s klorom, da nastane razredčena raztopina joda, ki izhlapi z zračnim tokom, ki je odstopal na vpojni stolp žveplovega dioksida, kar povzroči naslednjo reakcijo:
Yo2 + 2 h2Ali +tako2 => 2 hi +h2SW4
Nato vodikov jodidni plin reagira s klorom, da sprosti jod v plinastem stanju:
2 Živjo +Cl2 => I2 + 2 HCl
In končno, jodni filtri, čistili in embalažo za uporabo.
Biološki papir
- Priporočena prehrana
Jod je bistven element, saj posega v številne funkcije v živih bitjih, ki so še posebej znane pri ljudeh. Edini način vstopa joda človeku je hrana, ki jo zaužije.
Priporočena prehrana z jodom se razlikuje glede na starost. Tako 6 -mesečni fant zahteva vnos 110 µg/dan; Toda od 14. leta starosti je priporočena prehrana 150 µg/dan. Poleg tega je ugotovljeno, da vnos joda ne sme presegati 1.100 µg/dan.
- Ščitnični hormoni
Ščitnični stimulacijski hormon (TSH) izloča hipofiza in stimulira jod s ščitničnimi folikli. Jod se nosi v ščitničnih foliklih, znanih kot koloidi, kjer se veže na aminokislinski tirozin, da tvori monoyodotirozin in diiodotirozin.
V folikularnem koloidu, monoyodirosin3). Po drugi strani se lahko pridružijo dve molekuli diiodotirozina, ki tvorita tetrarydotiron (t4). T3 in t4 So tako imenovani ščitnični hormoni.
Hormoni t3 in t4 Izključeni so v plazmo, kjer se vežejo na plazemske beljakovine; Med njimi transportni protein ščitničnih hormonov (TBG). Večina ščitničnih hormonov se prevaža v plazmi kot t4.
Vendar je aktivna oblika ščitničnih hormonov t3, Torej t4 V "belih organih" ščitničnih hormonov, izkušenj in preoblikovanja v t3 Za izvajanje hormonskega dejanja.
Učinki
Učinki delovanja ščitničnih hormonov so večkratni, saj lahko poudarijo naslednje: povečanje presnove in sinteze beljakovin; spodbujanje telesne rasti in razvoja možganov; Povečan krvni tlak in srčni utrip itd.
- Pomanjkanje
Pomanjkanje joda in zato ščitničnih hormonov, znanih kot hipotiroidizem, ima številne posledice, na katere vpliva starost osebe.
Če pride do pomanjkanja joda med človekovim plodom, je najpomembnejša posledica kreatinizem. Za ta pogoj so značilni znaki, kot so poslabšanje duševne funkcije, zamuda pri fizičnem razvoju, štrudizma in pozno spolno zorenje.
Vam lahko služi: baker: zgodovina, lastnosti, struktura, uporabe, biološki papirPomanjkanje joda lahko sproži goiter, ne glede na starost, v kateri se pojavi pomanjkanje. Goiter je prekomerni razvoj ščitnice, ki ga povzroča prekomerna stimulacija žleze s hormonom TSH, ki se sprošča iz hipofize kot posledica pomanjkanja joda.
Prekomerna velikost ščitnice (goiter) lahko stisne sapnik in omeji prehod zraka skozi njega. Poleg tega lahko povzroči škodo na laringealnih živcih, ki so lahko posledica ruma.
Tveganja
Zastrupitev zaradi prekomernega vnosa joda lahko povzroči opekline v ustih, grlu in vročini. Tudi bolečine v trebuhu, slabost, bruhanje, driska, šibek impulz in koma.
Presežek joda povzroči nekatere simptome, opažene pri pomanjkanju: obstaja inhibicija sinteze ščitničnih hormonov, zato se sproščanje TSH poveča, kar ima za posledico hipertrofijo ščitnice; to je goiter.
Obstajajo študije, ki kažejo, da lahko prekomerni vnos joda povzroči papilarni rak ščitnice. Poleg tega lahko prekomerni vnos joda vpliva na zdravila z omejevanjem njegovega delovanja.
Prekomerni vnos joda z antitiroidnimi zdravili, kot je metimazol, ki se uporablja za zdravljenje hipertiroidizma, ima lahko aditivni učinek in povzroči hipotiroidizem.
Za hipertenzivno zdravljenje se uporablja angiotenzin (ECA) pretvorbeni zaviralci encimov, kot je Benazepril. Če jemljete prekomerno količino kalijevega jodida, poveča tveganje za hiperkalemijo in hipertenzijo.
Prijave
Zdravniki
Jod deluje kot razkužilo kože ali ran. Ima skoraj posnetek protimikrobno delovanje, ki prodira v mikroorganizme in interakcijo z žveplovimi aminokislinami, nukleotidi in maščobnimi kislinami, kar povzroča celično smrt.
Svojo protivirusno delovanje v bistvu izvaja na zajetih virusih in postulira, ki napadajo površino pokritih virusov.
Kalijev jodid v koncentrirani raztopini se uporablja pri zdravljenju tirotoksikoze. Uporablja se tudi za nadzor učinkov sevanja 131I Ko blokiram zvezo radioaktivnega izotopa na ščitnico.
Jod se uporablja pri zdravljenju dendritičnega keratitisa. Za to je izpostavljena roženica do hlapov nasičene vode z jodom, epitelij roženice začasno izgublja; Toda v dveh ali treh dneh je popolno okrevanje.
Jod ima tudi koristne učinke na zdravljenje fibroze človeškega sinusa. Prav tako je bilo poudarjeno, da 131Lahko bi bil neobvezno zdravljenje z rakom ščitnice.
Reakcije in katalitično delovanje
Jod se uporablja za zaznavanje prisotnosti škroba, kar daje modro obarvanost. Reakcija joda z škrobom se uporablja tudi za zaznavanje prisotnosti lažnih vozovnic, natisnjenih na papirju, ki vsebuje škrob.
Pri odkrivanju amoniaka se uporablja kalijev (ii) tetrayodomercurat, znan tudi kot Nesslerski reagent. Prav tako se pri testu jodoform uporablja alkalna raztopina joda, da se pokaže prisotnost metilcetonega.
Anorganski jodid. V fazi postopka je treba oblikovati tetrayoduros teh kovin.
Jod služi kot stabilizator za kolfonijo, olje in druge lesene izdelke.
Jod se uporablja kot katalizator v organskih sinteznih reakcijah metilacije, izomerizacije in dehidrogenacije. Medtem se iarklorovodikova kislina uporablja kot katalizator za proizvodnjo ocetne kisline v procesih Monsanto in Cativa.
Jod deluje kot katalizator v kondenzaciji in alpozaciji aromatičnih aminov, pa tudi v procesih sulfatizacije in sulfanacije ter za proizvodnjo sintetičnih gumarjev.
Fotografija in optika
Silver Yoduro je bistvena sestavina tradicionalnega fotografskega filma. Jod se uporablja pri proizvodnji elektronskih instrumentov, kot so edinstvene steklene prizme, polarizirajoči optični instrumenti in steklo, ki lahko prenaša infrardeče žarke.
Druge uporabe
Jod se uporablja pri izdelavi barvil pesticidov, anilina in phtaleína. Poleg tega se uporablja v sintezi barvil in je sredstvo za gašenje dima. In končno, srebrni jodid služi kot jedro kondenzacije vodne pare v oblakih, da bi povzročil dež.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Stuart Ira Fox. (2003). Človeška fiziologija. Prva izdaja. Uredi. McGraw-Hill Interamerican
- Wikipedija. (2019). Jod. Pridobljeno iz: v.Wikipedija.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Modulirana struktura trdnega joda med molekularno disociacijo STI in. Zvezek narave 423, strani971-974. doi.org/10.1038/nature01724
- Chen l. et al. (1994). Strukturni fazni prehodi joda pri visokem tlaku. Inštitut za fiziko, Akademija Sinica, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider in Karl Christe. (26. avgust 2019). Jod. Encyclopædia Britannica. Okrevano od: Britannica.com
- Doktor. Doug Stewart. (2019). Dejstva o jodnih elementih. Kemikool. Okrevano od: Chemicool.com
- Nacionalni center za informacije o biotehnologiji. (2019). Jod. Baza podatkov Pubchem. Cid = 807. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Rohner, f., Zimmermann, m., Jooste, str., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarkerji prehrane za pregled razvoja-joda. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- Advameg. (2019). Jod. Je pojasnila kemija. Okrevano od: Kemiji.com
- Traci Pedersen. (19. aprila 2017). Dejstva o jodu. Okrevano od: Livescience.com
- Megan Ware, rdn, ld. (30. maja 2017). Vse, kar morate vedeti o jodu. Okrevano od: MedicalNewstody.com
- Nacionalni inštitut za zdravje. (9. julij 2019). Jod. Pridobljeno iz: sdg.Od.ameriški nacionalni inštitut za zdravje.Gov
- « Kriptonska zgodovina, lastnosti, struktura, pridobivanje, tveganje, uporaba
- Mary Celeste Antecedents, Dogodki, teorije »

