Ne -metalni oksidi

- 4904
- 647
- Don Nitzsche
 Ogljikov dioksid je toplogredni plin in je tudi nemetalni oksid
Ogljikov dioksid je toplogredni plin in je tudi nemetalni oksid Kaj so nemetalni oksidi?
The ne -metalni oksidi So binarne spojine, ki nastanejo med ne -kometalom s pozitivnim oksidacijskim stanjem in kisikom s stanjem oksidacije -2. Te spojine se imenujejo tudi anhidridi in kislinski oksidi, ki tvorijo kislinske raztopine z raztapljanjem v vodi, prav tako.
Ne kovinski oksidi so po naravi zelo pogosti. Pravzaprav so povsod. Voda, vitalna tekočina, ki pokriva dve tretjini zemeljske površine, je nemetalni oksid. Tako so tudi ogljikov dioksid, ki izdihnemo med dihalnimi in žveplovimi oksidi, ki kontaminirajo zrak in ki povzročajo kisli dež.
V večini polarnih primerov so povezave kovalentne vezi, ki jih tvorijo ne -metali in kisik (ki je tudi ne -metal), povezave, ki združujejo njihove atome. Zaradi tega ima velika večina nemetalnih ali anhidridnih oksidov znatno nizke vrelišča, veliko pa so plini pri sobni temperaturi.
Lastnosti ne -metalnih oksidov
- Nimajo sijaja ali kovinskega sijaja.
- Imajo lahko različne barve.
- Njihovi atomi so združeni s kovalentnimi vezmi namesto ionskih povezav.
- Nastanejo kisik in ne -kometal.
- V primerjavi s kovinskimi oksidi imajo običajno nizke točke taljenja in vrelišča, čeprav zelo raznolike.
- Večina je plinov, lahko pa jih najdete tudi v trdnem stanju (na primer n2Tudi3) ali tekočina pri sobni temperaturi.
- Trdni nemetalni oksidi so običajno krhki in imajo lahko drugačno trdoto.
- So slabi prevodniki toplote in električne energije.
- Ko jih raztapljajo v vodi, reagirajo na tvorbo oksacidnih kislin.
- Nekatere njegove oksacidne kisline so močne kisline, ki v vodni raztopini tvorijo anione ali oksianije.
- Reagirajo z osnovnimi oksidi, da tvorijo oksisalne soli.
Vrste nemetalnih oksidov
Ni formalne ali splošno sprejete klasifikacije ne -metalnih oksidov. Vendar jih je mogoče razvrstiti glede na njihove lastnosti kisline.
Čeprav se nemetalni oksidi imenujejo tudi kisli oksidi, vsi vedno ne reagirajo kot kisline proti drugim spojinam. Glede na to je mogoče prepoznati tri različne vrste nemetalnih oksidov glede na njihove lastnosti kisline/baze:
Ne -metalni kislinski oksidi
So najpogostejši. Velika večina spojin med kisikom in drugim nemetalnim statusom, ne glede na njun oksidacijski status, proizvaja mineralne kisline, ko jih raztopimo v vodi, kar povzroči kislinske raztopine.
- Nekaj primerov kislinskih oksidov je dušikov anhidrid (n2Tudi5) in žveplov anhidrid (tako3).
Nevtralni ne -metalni oksidi
Nekateri nemetalni oksidi sploh ne reagirajo z vodo, ko se raztopijo. V teh primerih je nastala raztopina nevtralna (ni kisla niti osnovna).
- Nekaj primerov nevtralnih oksidov so ogljikov monoksid (CO), dušikov oksid (N₂O) in klor dioksid (CLO2).
Ne -metalni amfotorični oksidi
Izraz Anfótero Se nanaša na sposobnost kemične spojine, da se obnaša kot kislina ali kot osnova, odvisno od tega, kdo reagira na. To pomeni, da so to spojine, ki so hkrati kisline in baze.
- Med amfotičnimi nemetalnimi oksidi je najpogostejša voda (h2Da). Voda je amfotentna, saj lahko daje proton bazi (ki deluje kot kislina), hkrati pa lahko sprejme proton kisline (deluje kot baza).
Primeri ne -metalnih oksidov
Spodaj so predstavljeni najpogostejši ne -metalni oksidi vsakega ne -metala, skupaj s svojo molekularno formulo, njegovo ime v skladu s sistematično nomenklaturo IUPAC, v skladu z nomenklaturo zalog in glede na tradicionalno nomenklaturo:
Ogljikovi oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
Co | Ogljikov monoksid | Ogljikov oksid (ii) | Ogljikov anhidrid |
CO2 | Ogljikov dioksid | Ogljikov oksid (IV) | Karbonski anhidrid |
Dušikovi oksidi
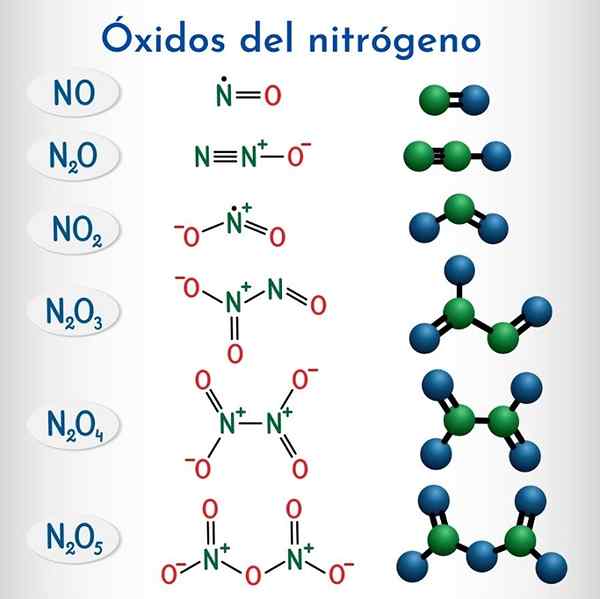 Formule in strukture 6 nemetalnih dušikovih oksidov
Formule in strukture 6 nemetalnih dušikovih oksidov Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
N2o | Dinitrogen monoksid | Dušikov oksid (i) | Dušikov oksid (Hiponitroso anhidrid) |
Ne | Dušikov monoksid | Dušikov oksid (ii) | Dušikov oksid |
N2O3 | Dinitrogen trioksid | Dušikov oksid (iii) | Dušikov anhidrid |
N2O4 | Dinitrogen tetraksid | Dušikov oksid (IV) | Dušikov tetraksid |
No2 | Dušikov dioksid | Dušikov oksid (IV) | Dušikov dioksid |
N2O5 | Dinitrogen pentaoksid | Dušikov oksid (v) | Dušikov anhidrid |
Fosforjevi oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
P2O3 | Difosfaking trioksid | Fosforjev oksid (III) | Fosforni anhidrid |
P2O5 | Difosfak pentaoksid | Fosforjev oksid (v) | Fosforni anhidrid |
P2O4 | Difosfak tetraksid | Fosforjev oksid (III, v) | --- |
Arzenski oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
AS2O3 | Diarsenski trioksid | Arzenski oksid (iii) | Arsenioso anhidrid |
AS2O5 | Diarsenski pentaoksid | Arzen oksid (V) | Arzen anhidrid |
Antimonistični oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
SB2O3 | Trioksid diantimona | Antimonicijski oksid (iii) | Protimoničen anhidrid |
SB2O5 | Diantimon pentaoksid | Antimonicijski oksid (v) | Antimonični anhidrid |
Žveplovi oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
SW | Žveplov monoksid | Žveplov oksid (ii) | Hiposulvski anhidrid |
SO2 | Žveplov dioksid | Žveplov oksid (iv) | Žveplo anhidrid |
SO3 | Trioksid žvepla | Žveplov oksid (vi) | Žveplov anhidrid |
Selenski oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
SEO | Selenijev monoksid | Selenski oksid (ii) | Hipolonski anhidrid |
SEO2 | Selenijev dioksid | Selenski oksid (iv) | Selenarni anhidrid |
SEO3 | Selenijev trioksid | Selenski oksid (vi) | Selénic Anhidrid |
Telurio oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
Teo | Telurio monoksid | Telurio oksid (ii) | Hipljeni anhidrid |
TEO2 | Telurio dioksid | Telurio oksid (IV) | Telurozni anhidrid |
Teo3 | Telurio trioksid | Telurio oksid (vi) | Tellorski anhidrid |
Klor oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
Cl2O | Klorin monoksid | Klorin oksid (i) | Hipoklorozen anhidrid |
Cl2O3 | Klorin trioksid | Klorin oksid (III) | Chloro anhidrid |
Cl2O5 | Klor pentaoksid | Klorin oksid (V) | Klorični anhidrid |
Cl2O7 | Klorin heptoksid | Klorin oksid (vii) | Perklorični anhidrid |
Brominski oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
Br2O | Brominski monoksid | Brominski oksid (i) | Hipobromozni anhidrid |
Br2O3 | Brominski trioksid | Brominski oksid (III) | Bromous anhidrid |
Br2O5 | Brominski pentaoksid | Brominski oksid (v) | Bromski anhidrid |
Br2O7 | Brominski heptaoksid | Brominski oksid (vii) | Perbromski anhidrid |
Jodni oksidi
Formula | IOPAC sistematično ime | Nomenklatura zalog | Tradicionalno ime |
I2o | Jodni monoksid | Jodni oksid (i) | Hypoyodoso anhidrid |
I2O3 | Jodni trioksid | Jodni oksid (iii) | Yodoso anhidrid |
I2O5 | Jodni pentaoksid | Jodni oksid (v) | Yodium anhidrid |
I2O7 | Jodni heptoksid | Jodni oksid (vii) | Periódikoični anhidrid |

