Osnovni oksidi

- 3072
- 158
- Raymond Moen
Pojasnjujemo, kakšni so osnovni oksidi, kako se oblikujejo njihove lastnosti, nomenklatura in dajejo več primerov,
 Številni osnovni oksidi imajo presenetljive, značilne za kovinske barve
Številni osnovni oksidi imajo presenetljive, značilne za kovinske barve Kaj so osnovni oksidi?
The Osnovni oksidi So anorganske spojine, ki jih tvori zveza med kisikom in kovino. Imenujejo se osnovni oksidi, ker proizvajajo alkalne ali osnovne rešitve pri raztapljanju v vodi. Tudi zato, ker reagirajo s kislinami, da tvorijo sol in vodo s kislinsko-bazno nevtralizacijsko reakcijo.
Osnovni oksidi so zelo pogosti. Pravzaprav večina kovin v naravi najde v tleh oksidov, zato so jih včasih imenovali zemlja.
Osnovni oksidi so zelo pomembni za industrijo. Številni barvni pigmenti, ki se uporabljajo v industriji, so oksidi. Drugi oksidi se uporabljajo kot osnova za slike, zlasti titanijeve, svinčeve in cinkove okside.
Osnovne lastnosti oksidov
So binarne spojine
Te spojine tvorijo samo dva elementa: kisik in kovina. Zato so binarne spojine.
Njegova empirična formula je m2TudiX ali moX/2
Valenca kisika v oksidih je vedno -2, zato so empirične formule oksidov poenostavljene, ko je kovinska valencia številka navora. Vendar se isto ne zgodi, kadar je čudno.
Na primer, empirična formula natrijevega oksida je na2Ali ker ima natrij Valencia +1 (nepar). Namesto tega je empirična formula kalcijevega oksida CAO, saj ima kalcij Valencia +2.
So anorganske spojine, skoraj vedno ionske
Večina osnovnih oksidov so kristalne ionske spojine. To vključuje okside vseh alkalnih kovin, vseh alkalinerjev (razen beril) in prve serije prehodnih kovin.
Vam lahko služi: kemična vezImajo zelo visoko fuzijsko in vrelišče
Ionska vez ohranja vse ione, ki tvorijo osnovne okside, močno združene. To jih težko tapijo in še težje izhlapijo. Zaradi tega imajo zelo visoko fuzijsko in vrelišče.
So trdni pri sobni temperaturi
Zaradi enakega dejstva, da imajo visoke fuzijske točke, so vsi osnovni oksidi trdni pri sobni temperaturi.
So osnovne spojine
Razlog, zakaj se imenujejo osnovni oksidi, je ravno zaradi njegovih lastnosti kisline. Oksidi z večjim ionskim značajem proizvajajo osnovne raztopine pri raztapljanju v vodi in reagirajo tudi s kislinami, nevtralizirajo jih.
Vendar je treba opozoriti, da niso vsi kovinski oksidi osnovni. Nekatere so nevtralne, druge kisline in druge amfotorne.
Večina je malo topnih ali netopnih v vodi
Vsi osnovni oksidi so netopni v vodi, z izjemo alkalnih in barijevih kovin oksidov. Vendar so topni v kislinskih raztopinah.
Kako so osnovni oksidi?
Osnovne okside se lahko spontano tvorijo, ko so kovine izpostavljene kisiku zraka. Pravzaprav so korozijske plasti, ki nastanejo na površini kovin, sestavljene iz različnih osnovnih oksidov.
Vključena kovina, na splošno gre za alkalno, alkalno kovino ali prehodno kovino.
Za tvorbo oksidov lahko napišete tri splošne reakcije, odvisno od tega, ali je kovinska Valencia enakomerna ali nenavadna:
Za kovine z nenavadnimi valenci:
Ko ima kovina nenavadno valenco, je splošna reakcija tvorbe oksida:

Na primer, za tvorbo natrijevega oksida, kjer ima natrij Valencijo +1, je reakcija:
Lahko vam služi: fosfor: zgodovina, lastnosti, struktura, pridobivanje, uporaba
Drug primer je tvorba železovega oksida, v katerem ima železo oksidacijo ali Valencia +3. V tem primeru je reakcija:

Za kovine z Valencijo +2:
Ko ima kovina Valencia +2, je splošna reakcija tvorbe oksida:

Na primer, v primeru tvorbe kalcijevega oksida, kjer ima kalcij Valencia +2, je reakcija:

Za kovine z drugimi pari:
Ko ima kovina poleg +2 celo valence, je splošna reakcija tvorbe oksida:
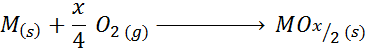
Primer tega primera je reakcija tvorbe titanovega oksida (IV):

Osnovna nomenklatura oksidov
Obstajajo trije nomenklaturni sistemi za osnovne okside, ki so: tradicionalna nomenklatura, zaloga in sistematična.
Če želite poimenovati oksid po prvih dveh sistemih nomenklature, je treba poznati kovinsko Valencijo, zadnje.
Tradicionalna nomenklatura
Glede na tradicionalno nomenklaturo se osnovni oksidi imenujejo začetek z besedo tudiXido sledi ime kationa. Ta priimek je zgrajen z namestitvijo korena kovinskega imena in sistema predpone in priponkov, ki jih označuje Metal Valencia:
Oksid + Prefix-raí-sufijo
Pravila za dodelitev predpone in priponkov so povzeta v naslednji tabeli:
Število možnih valenc | Valencia | Predpona | Pripona |
1 enotna Valencia | |||
Samo | --- | ___ico | |
2 Valencias | |||
Starejši | --- | ___ico | |
Manjši | --- | ___Bear | |
3 Valence | |||
Starejši | --- | ___ico | |
Vmesni | --- | ___Bear | |
Manjši | Hiccup___ | ___Bear | |
4 Valence | |||
Starejši | Per___ | ___ico | |
Glavni vmesni | --- | ___ico | |
Manjši vmesni | --- | ___ico | |
Manjši | Hiccup___ | ___ico |
Primer:
On Vera2Tudi3 Je železov oksid z Valencijo +3. Iron ima samo dve valenci, ki sta +2 in +3, zato ima v tem oksidu železo najstarejšo od dveh valenc. Zaradi tega je dodana pripona ___ico v korenu imena železne kovine, ki je Ferr-.
Lahko vam služi: brez elektrolitov: značilnosti in primeriZato tradicionalno ime Vera2Tudi3 je: Železni oksid.
Nomenklatura zalog
V tem sistemu je ime zgrajeno začenši z besedami oksid od, sledi kovinsko ime. Končno je njegova Valencia v rimskih številkah v oklepajih:
Kovina + ime oksid (Valencia)
V primeru, da ima kovina samo eno valenco, je izpuščena.
Primer:
V cr2Tudi3 Krom ima Valencia +3, zato je ime zalog Krom oksid (iii).
Sistematična nomenklatura
To je edina od treh nomenklatur, ki ne določa kovine Valencije. Sitematska imena kažejo, koliko atomov kisika in kovin vsebuje spojino z uporabo numeričnih predpone.
Ime je zgrajeno z besedo oksid pred njim predpona, ki kaže na število kisika, Nato članek od sledi Kovinsko ime s svojo predpono.
Predpona-oksid + od + predpona-metal
Nekatere predpone so:
Številka | Predpona |
1 | Žemlja |
2 | Dal |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Primer:
V sistematični nomenklaturi CR2Tudi3 Imenuje se dihroma trioksid, saj ima tri kisik in dva kromosa.
Primeri osnovnih oksidov
- Natrijev oksid - na2Tudi
- Železni oksid - vera2Tudi3
- Železni monoksid - grd
- Cromski oksid - cr2Tudi3
- Divanadio pentaoksid - v2Tudi5
- Kalijev oksid - k2Tudi
- Barijev oksid - Bao

