Kalijev oksid (K2O)
- 2501
- 702
- Ms. Pablo Lebsack
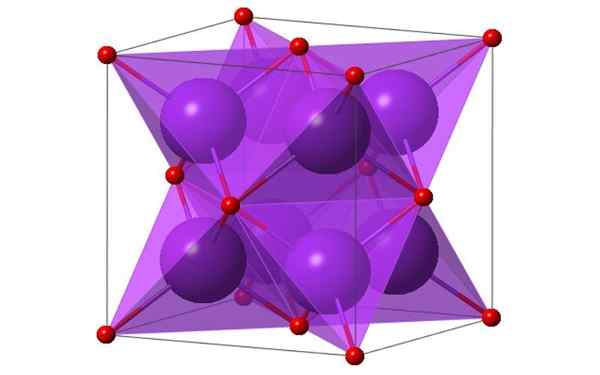
 Kubična zasnova 4 molekul kalijevega oksida. Vir: KTLABE, Wikimedia Commons
Kubična zasnova 4 molekul kalijevega oksida. Vir: KTLABE, Wikimedia Commons Kaj je kalijev oksid?
On kalijev oksid, Imenuje se tudi dipotazijev oksid, je ionski kisik in kalijeva sol, s formulo K2Tudi. Je najpreprostejši kalijev oksid, zelo reaktiven in redko najden. Nekateri trgovinski materiali, kot so gnojila in cement2Tudi.
Kalijev oksid nastaja iz kalijevega hidroksida (kavstična kalija) in 450 ° C kovinskega kalija, ki proizvaja molekularni vodik v skladu z enačbo:
2K + 2KOH ⇌ 2K2Ali + h2 (450 ° C).
Dobimo ga tudi z zmanjšanjem kalijevega peroksida glede na reakcijo:
2K2Tudi2 → k2Ali + o2 (530 ° C).
Druga metoda pridobivanja kalijevega oksida je s segrevanjem kalijevega karbonata pri visoki temperaturi, kot je prikazano z naslednjo reakcijo:
K2Co3 ⇌ k2O + co₂ (t> 1200 ° C).
Vendar je glavni način pridobivanja kalijevega oksida s segrevanjem kalijevega nitrata, pri čemer pridobivanje molekularnega dušika, kot je prikazano z naslednjo reakcijo:
2kno3 + 10K → 6K2Ali + n2
Fizikalne in kemijske lastnosti
- So tetraedrski kristali, rumenkasti, brez značilne arome.
- Ima molekulsko maso 94,2 g/mol in gostoto 2,13 g/ml pri 24 ° C.
- Ima 740 ° C tališče, čeprav se začne razpadati pri 300 ° C.
- Je odporen na toploto in topno v etanolu in etru. K2Ali kristalizirajte v strukturi antifluorita. Zaradi tega se položaji anionov in kationov vlagajo v zvezi s svojimi stališči v CAF2, z usklajenimi kalijevimi ioni do 4 ionov oksidnih in oksidnih ionov, usklajenih pri 8 kaliju.
- Je osnovni oksid in silovito reagira z vodo, da nastane kavstični kalijev hidroksid. Je definirana in absorbira vodo iz atmosfere, začenši s to živahno reakcijo.
Lahko vam služi: kalcijev nitrat (CA (NO3) 2)- Oksidira reverzibilno na kalijev peroksid pri 350 ° C, silovito reagira s kislinami, kot je klorovodikova kislina, da tvori kalijeve soli glede na reakcijo:
K2O + 2HCl → 2KCl + H₂o.
- Reagira z dušikovim dioksidom, da tvori nitrat in kalijev nitrit pri temperaturah med 150 in 200 ° C:
K2O + 2no2 = Kno2 + Kno3
- Reagirati pri nizkih temperaturah z amonijakom, da tvorijo amidas in kalijev hidroksid glede na reakcijo:
K2O + nh3 (L) → knh2↓ + koh (-50 ° C).
Tveganja
Kalijev oksid je nestabilna snov. Enostavno oksidira druge okside kalijevega, peroksida ali kalijeve kisline (Kho) (KHO). Spojina ni gorivo, vendar močno in eksotermično reagira z vodo, da tvori kalijev hidroksid (KOH).
Raztopina kalijevega oksida v vodi je močna podlaga, silovito reagira s kislino in je jedko. Silovito reagira z vodo, ki proizvaja kalijev hidroksid. Napade številne kovine v prisotnosti vode.
Snov je jedko za oči, kožo in dihalne poti, pa tudi z zaužitjem. Vdihavanje aerosola lahko povzroči pljučni edem, katerega simptome se pogosto kažejo po nekaj urah in jih poslabšajo fizični napor.
V primeru očesnega stika morate preveriti, ali se kontaktne leče uporabljajo in jih takoj odstranite. Oči je treba oprati s tekočo vodo vsaj 15 minut z odprtimi vekami. Uporablja se lahko hladna voda in ne mazilo za oči.
Če kemikalija pride v stik z oblačili, jo čim hitreje zadržite in zaščitite svoje roke in telo. Žrtev postavite pod varnostno prho.
Če se kemikalija kopiči v izpostavljeni koži, kot so roke, se koža, onesnažena s tekočo vodo, in neabrazivno milo mehko oprana in previdno. Lahko uporabimo hladno vodo. Če draženje traja, poiščite zdravniško pomoč. Operite onesnažena oblačila, preden jih ponovno uporabite.
Lahko vam služi: Rubidio: Zgodovina, lastnosti, struktura, pridobivanje, uporabeČe je stik s kožo resen, ga je treba oprati z razkužilnim milom in pokrivati kožo, onesnaženo z antibakterijsko kremo.
V primeru vdihavanja je treba žrtev dovoliti, da stoji na dobro prezračenem območju. Če je vdihavanje resno, je treba žrtev čim prej evakuirati na varno območje.
Odvijte tesna oblačila, kot so vratovi majic, pasovi ali kravata. Če je žrtev težko dihati, je treba dajati kisik. Če žrtev ne diha, je narejena oživljanje ust.
Vedno upoštevamo, da je lahko nevarno za osebo, ki nudi pomoč pri oživljanju ust do ust, kadar je vdihani material strupen, nalezljiv ali koroziven.
V primeru zaužitja ne povzroča bruhanja. Popustite tesna oblačila. V vseh primerih je treba iskati takojšnjo zdravniško pomoč.
Prijave
- Kemična formula k2Ali (ali preprosto k) se uporablja v več industrijskih okoliščinah: N-P-K številke za gnojila, formule cementa in steklene formule.
V teh izdelkih se pogosto ne uporablja neposredno, vendar se o količini kalija poroča o enakovrednem K2Ali za katero koli vrsto uporabljenih kalijevih spojin, na primer kalijev karbonat.
- Kalijev oksid je približno 83% kalija v teži, kalijev klorid. Kalijev klorid zagotavlja manj kalija kot enaka količina kalijevega oksida.
Če je gnojilo 30% kalijev klorid glede na težo, bi bil njegov standardni kalijev indeks, ki temelji na kalijevem oksidu, le 18,8%. Izdelana je in/ali med 10 in 100 ton na leto te snovi v evropskem gospodarskem prostoru.
Vam lahko služi: kemija v vsakdanjem življenju: +30 primerov- Ta snov se uporablja v laboratorijskih kemikalijah, gnojilih, polimerih in fitosanitarnih produktih. K2O ima industrijsko uporabo, ki ima za posledico proizvodnjo druge snovi (uporaba vmesnih izdelkov).
- Kalijev oksid se uporablja na območjih mešanice in/ali kmetijstva, gozdarstva in ribolovne formulacije. Uporablja se za izdelavo kemikalij, plastičnih izdelkov in mineralnih izdelkov (na primer omet, cement).
- Uporablja se na prostem v dolgoročnih materialih z nizko hitrostjo, na primer kovinski, lesni in plastični gradbeni materiali.
- Notranji, dolgoročni materiali se uporabljajo z nizko hitrostjo sproščanja, kot so pohištvo, igrače, gradbeni materiali, zavese, obutev, usnjeni izdelki, papirnati in kartonski izdelki, elektronska oprema.
- To snov lahko najdemo v izdelkih z materialom, ki temelji na kamnu, omet, cement, steklo ali keramiko (na primer plošče, lonci / ponve, posode za shranjevanje hrane, konstrukcijski in izolacijski material).
- Kalijev oksid je toplotno stabilen, zelo netopni vir, primeren za steklene, optične in keramične uporabe. Oksidne spojine ne izvajajo električne energije.
- Uporablja se tudi v lahkih strukturnih komponentah v vesoljskih in elektrokemičnih aplikacijah, kot so baterije za gorivo, v katerih ima ionska prevodnost.
Reference
- Ameriški elementi.F.). Kalijev oksid. Okrevana od ameriških.com.
- Dipassijev oksid. Okreval od Echa.Evropa.EU.

