Struktura, lastnosti, lastnosti, uporabe strontium oksida (SRO)

- 2118
- 582
- Ms. Pablo Lebsack
Pojasnjujemo, kaj so stroncijev oksid, njegova kemična struktura, fizikalne in kemijske lastnosti, aplikacije in tveganja
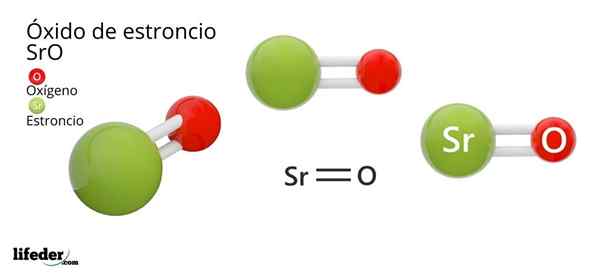
On Stroncijev oksid, katere kemična formula je SRO (ne smemo zamenjati s stroncijevim peroksidom, ki je SRO2), je produkt oksidativne reakcije med to kovino in kisikom, ki je prisoten v zraku pri sobni temperaturi: 2SR (s) + O2 (g) → 2SRO (S).
Košček stroncija gori v stiku z zrakom zaradi njegove visoke reaktivnosti, in ker ima elektronsko konfiguracijo tipa NS2, njegova dva valenčna elektrona zlahka prinašata, zlasti molekula diatoma kisika.
Če se površina kovine poveča tako. Stroncij, kovina, ki sodeluje v tej reakciji, je kovina skupine 2 periodične tabele.
To skupino sestavljajo elementi, znani kot alkalij. Prvi od elementov, ki jih vodi skupina, je Berlij, sledijo magnezij, kalcij, stroncije, barij in na koncu radio. Ti elementi so kovinske narave in kot mnemonično pravilo, da si jih zapomnimo, lahko uporabimo izraz: "Sr. Becambara ".
"MR", na katerega se izraz sklicuje, ni nič drugega kot kovinski strontij (SR), zelo reaktivni kemični element, ki ga v svoji čisti obliki ne najdemo naravno, ampak v kombinaciji z drugimi elementi okolja ali okolico, da bi lahko povzročili Soli, nitridi in oksidi.
Zaradi tega so minerali in stroncijev oksid spojine, v katerih je v naravi stroncija.
[TOC]
Fizikalne in kemijske lastnosti stroncijskega oksida
 Fizični videz stroncijevega oksida
Fizični videz stroncijevega oksida Stroncijev oksid je trdna bela, porozna in stranišče in, odvisno od njegovega fizičnega ravnanja, na trgu najdemo kot lep prah, kot so kristali ali kot nanodelci.
Vam lahko služi: oksidiNjegova molekulska teža znaša 103.619 g/mol in ima visok indeks loma. Ima fuzijske točke (2531 ° C) in vrenje (3200 ° C), kar pomeni močne interakcije med stroncijami in kisikom. Ta visoka tališče je toplotno stabilen material.
Osnovni oksid
Je zelo osnovni oksid; To pomeni, da reagira pri sobni temperaturi z vodo, da tvori stroncijev hidroksid (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Topnost
Prav tako reagira ali zadržuje vlago, bistvena značilnost higroskopskih spojin. Zato ima stroncijev oksid visoko reaktivnost z vodo.
V drugih topilih - na primer, so alkoholi, kot sta etanol lekarne ali metanol -, nekoliko topni; Medtem ko je v topilih, kot so aceton, eter ali diklorometan.
Zakaj je tako? Ker kovinski oksidi -in še bolj tisti, ki nastanejo iz alkalinoternih kovin -so polarne spojine in zato v boljšo stopnjo medsebojno delujejo s polarnimi topili.
Ne le, da lahko reagira z vodo, ampak tudi z ogljikovim dioksidom, ki proizvaja stroncijev karbonat:
SRO (S) + CO2 (G) → SRCO3 (S)
Reagira s kislinami - kot na primer z razredčeno fosforno kislino -, da proizvaja fosfatno sol soli in vode:
3SRO (S) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (S) + 3H2O (G)
Te reakcije so eksotermične, zato proizvedena voda izhlapi z visokimi temperaturami.
Kemična struktura
Kemična struktura spojine pojasnjuje, kakšni so njeni atomi v vesolju. V primeru stroncijskega oksida predstavlja kristalno strukturo tipa dragulja, isto namizno sol ali natrijev klorid (NaCl).
Vam lahko služi: kalcijev bikarbonatZa razliko od NaCl, monovalentno sol -to je s kationi in anioni velikosti obremenitve (+1 za Na in -1 za Cl) -, je SRO dvovalentna, z 2+ obremenitvami za Sr in od -2 za O (o2-, oksidni anion).
V tej strukturi je vsak O2- (rdeč) ion obkrožen s šestimi drugimi obsežnimi oksidi, ki gostijo v svojih oktaedrskih interstikah ioni Sr2+ (zelena barva), manjši. Ta embalaža ali razporeditev je znana kot kubična enotna celica, osredotočena na obraze (CCC).
Vrsta povezave
Kemična formula stroncijskega oksida je SRO, vendar popolnoma ne pojasnjuje kemijske strukture ali obstoječe vrste povezave.
V prejšnjem razdelku je bilo omenjeno, da predstavlja strukturo dragulja; to je zelo pogosta kristalna struktura za številne soli.
Zato je vrsta povezave pretežno ionska, kar bi razjasnilo, zakaj ima ta oksid visoke fuzije in vrelišča.
Ker je povezava ionska, so elektrostatični interakciji tisti, ki ohranjajo atome stroncija in kisika skupaj: SR2+ O2-.
Če bi bila ta vez kovalentna, bi lahko spojino predstavljali s povezavami v svoji strukturi Lewis (izpuščanje ne skupnih kisikovih elektronov).
Prijave
Fizične lastnosti spojine so bistvene za napovedovanje, kakšne bi bile njihove potencialne aplikacije v panogi; Zato so to makro odsev njegovih kemijskih lastnosti.
Nadomestki svinca
Stroncijev oksid, zahvaljujoč visoki toplotni stabilnosti, najde veliko aplikacij v industriji keramike, stekla in optike.
Njegova uporaba v teh panogah je namenjena predvsem nadomeščanju svinca in dodatka, ki daje boljše barve in viskoznosti surovine izdelkov.
Vam lahko služi: najem halogenuros: nepremičnine, pridobivanje, primeriKateri izdelki? Seznam ne bi imel konca, saj je v nobenem od teh, ki ima steklo, emajle, keramiko ali kristale v enem od njegovih kosov, lahko uporaben stroncijev oksid.
Vesoljska industrija
Ker je zelo porozna trdna snov, se lahko preseli manjše delce in tako zagotavlja vrsto možnosti pri oblikovanju materialov, kot tudi svetloba, ki jo upošteva vesoljska industrija.
Katalizator
Ista poroznost vam omogoča, da imate potencialne uporabe kot katalizator (pospeševalnik kemičnih reakcij) in kot toplotni izmenjevalec.
Elektronske namene
Stroncijev oksid služi tudi kot vir proizvodnje čistega strbana za elektronske namene, zahvaljujoč sposobnosti te kovine, da absorbira x -roje; In za industrijsko pripravo hidroksida, Sr (OH) 2 in peroksida, SRO2.
Zdravstvena tveganja
Je korozivna spojina, zato lahko povzroči opekline s preprostim fizičnim stikom kjer koli v telesu. Je zelo občutljiv na vlago in ga je treba hraniti v suhih in hladnih prostorih.
Solini produkt reakcije tega oksida z različnimi kislinami se obnaša v telesu in kalcijeve soli in jih shranjuje ali izganjajo podobni mehanizmi.
Takrat sam strontijev oksid ne predstavlja večjih zdravstvenih tveganj.
Reference
- Ameriški elementi. (1998–2018). Ameriški elementi. Okrevana od ameriških.com
- Shiver & Atkins. (2008). Anorganska kemija. V strukturah preprostih trdnih snovi (četrti izd., str. 84). MC Graw Hill.
- Atsdr. Okrevano od ASDR: ATSDR.CDC.Gov
- Clark, j. (2009). Chemguide. Okreval od Chemguide.co.Združeno kraljestvo
- Tiwary, r., Narayan, s., & Pandey, ali. (2007). Priprava stotium oksida iz celestita: pregled. Znanost o materialih, 201–211.

