Kalcijev oksid (CAO)
- 2244
- 561
- Ms. Pablo Lebsack
Kaj je kalcijev oksid?
On Kalcijev oksid (CAO) je anorganska spojina, ki vsebuje kalcij in kisik v ionskih oblikah (ne da bi se zmedla s kalcijevim peroksidom, CAO2). Svetovno znana kot apna, beseda, ki označuje vsako anorgansko spojino, ki vsebuje karbonate, okside in kalcijeve hidrokside, poleg drugih kovin, kot so silicij, aluminij in železo.
Na ta oksid (ali apno) se pogovorno imenuje tudi življenje ali apno, odvisno od tega, ali je hidriran. Lime Lime je kalcijev oksid, medtem ko je izklopljen njegov hidroksid. Apnenec (apno ali utrjeno apno) je pravzaprav sedimentna skala, sestavljena predvsem iz kalcijevega karbonata (Caco3).
Je eden največjih naravnih virov kalcija in predstavlja surovino za proizvodnjo kalcijevega oksida. Kako se proizvaja ta oksid? Karbonati so dovzetni za toplotno razgradnjo; Ogrevanje kalcijevih karbonatov pri temperaturah, večjih od 825 ° C, vodi do tvorbe apna in ogljikovega dioksida.
Prejsko izjavo je mogoče opisati na naslednji način: Caco3(s) → Cao (s) + co2(g). Ker je zemeljska skorja bogata z apnencem in kalcitom, na oceanih in plažah.
Formula
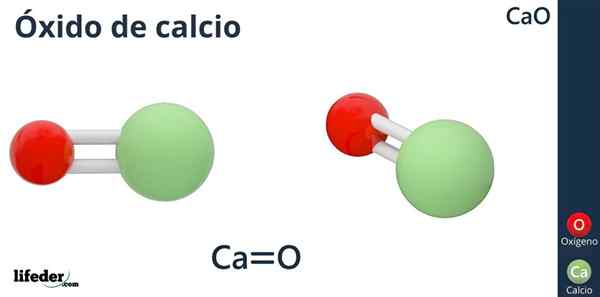
Kemična formula kalcijevega oksida je CAO, v kateri je kalcij podoben kislemu ionu (sprejemnik elektronov)2+, in kisik, kot je osnovni ion (darovalec elektronov) ali2--.
Zakaj ima kalcij naboj +2? Ker kalcij spada v skupino 2 periodične tabele (SR. Scholambara) in imata na voljo samo dva valenčna elektrona za tvorbo povezav, ki dajeta atomu kisika.
Vam lahko postreže: kalijev oksid (K2O)Struktura kalcijevega oksida
 Kristalna struktura kalcijevega oksida
Kristalna struktura kalcijevega oksida Na zgornji sliki je predstavljena kristalna struktura (vrsta dragulja) za kalcijev oksid. Voluminozne rdeče sfere ustrezajo CA ionom2+ in bele sfere do ionov oz2-.
V tej kubični kristalni razporeditvi vsak ion ca2+ je obdan s šestimi ioni oz2-, V oktaedrskih luknjah, ki jih pustijo veliki ioni med njimi.
Ta struktura izraža do največjega ionskega značaja tega oksida, čeprav izjemna razlika radijskih sprejemnikov (rdeča krogla je večja od bele) daje šibkejšo kristalno retikularno energijo, če je v primerjavi z MGO.
Lastnosti kalcijevega oksida
 Videz kalcijevega oksida
Videz kalcijevega oksida Fizično je kristalno bela trdna trdna, stranišče in z močnimi elektrostatičnimi interakcijami, ki so odgovorni za svoje visoke točke združitve (2572 ° C) in vrelo (2850 ° C). Poleg tega ima molekulsko maso 55.958 g/mol in zanimivo lastnost termoluminiscentnega.
To pomeni, da lahko kos kalcijevega oksida, ki je izpostavljen plamenu V sredini pozornosti, ali v španščini, kalcijeva svetloba. Ioni ca2+, V stiku z ognjem izvirajo iz rdečkastega plamena, kot je razvidno iz naslednje slike.
 Kalcija ali luč v središču pozornosti
Kalcija ali luč v središču pozornosti Topnost
CAO je osnovni oksid, ki ima močno afiniteto do vode, do takšne stopnje, ki absorbira vlago (je higroskopska trdna snov), ki takoj reagira, da nastane izklopljen ali kalcijev hidroksid:
Cao (s) + h2Ali (l) => ca (OH)2(S)
Ta reakcija je eksotermična (daje toploto) zaradi tvorbe trdne snovi z močnejšimi interakcijami in stabilnejšo kristalno omrežje. Vendar je reakcija reverzibilna, če je Ca (OH) segreta2, dehidriranje in osvetlitev apna; Nato apno "prerojeno".
Vam lahko služi: safranin: značilnosti, uporaba, tehnike, strupenostNastala raztopina je zelo osnovna in če je nasičena s kalcijevim oksidom, doseže pH 12,8.
Prav tako je topna v glicerolu in v kislih in sladkih raztopinah. Kot je osnovni oksid, ima seveda učinkovite interakcije s kislimi oksidi (SIO2, Do2Tudi3 in vera2Tudi3, na primer) topno v njihovih tekočih fazah. Po drugi strani pa je netopna v organskih alkoholih in topilih.
Uporaba/aplikacije
CAO ima ogromno nešteto industrijskih uporab, pa tudi pri sintezi acetilena (ch≡CH), pri ekstrakciji fosfatov odpadne vode in v reakciji z žveplovim dioksidom brezalkoholnih pijač.
Spodaj so opisane druge uporabe kalcijevega oksida:
Kot malta
Če kalcijev oksid mešamo s peskom (SIO2) in voda, torte s peskom in počasi reagira z vodo, da tvori dolgočasno apno. Po drugi strani2 Iz zraka se raztopi v vodi in reagira s soljo, da tvori kalcijev karbonat:
CA (OH)2(s) + co2(g) => caco3(s) + h2Ali (l)
Caco3 Je bolj odporna in trda spojina kot CAO, zaradi česar se malta (prejšnja zmes) strdi in pritrdi opeke, bloke ali keramiko med njimi ali na želeno površino.
V proizvodnji stekla
Bistveni surovina za proizvodnjo stekla so silikonski oksidi, ki jih pomešamo z apnom, natrijevim karbonatom (NA2Co3) in druge dodatke, nato pa podvržene segrevanju, kar ima za posledico stekleno trdno. Ta trdna snov se naknadno segreva in piha na poljubnih številkah.
V rudarjenju
Dolg apno zavzema večji volumen kot živi apno zaradi interakcij vodikovih mostov (O-H-O). Ta lastnost se izkorišča, da razbije skale iz njegovih mnenj.
Vam lahko služi: katalitična hidrogenacijaTo dosežemo tako, da jih napolnite s kompaktno mešanico apna in vode, ki je zapečatena, da se osredotoči na svojo toploto in ekspanzivno moč znotraj skale.
Kot agent za odstranjevanje silikatov
Cao se združi s silikati, da tvori koalescentno tekočino, ki jo nato iz surovine izvleče iz določenega izdelka.
Na primer, železni minerali so surovina za proizvodnjo kovinskega železa in jekla. Ti minerali vsebujejo silikate, ki so neželene nečistoče za postopek in jih odpravijo z nedavno opisano metodo.
Nanodelci kalcijevega oksida
Kalcijev oksid se lahko sintetizira kot nanodelci, pri čemer spreminjajo koncentracije kalcijevega nitrata (CA (ne3)2) in natrijev hidroksid (NaOH) v raztopini.
Ti delci so sferični, osnovni (pa tudi trdni do makro lestvice) in imajo veliko površine. Posledično te lastnosti koristijo katalitičnim procesom. Ki? Preiskave trenutno odgovarjajo na to vprašanje.
Ti nanodelci so bili uporabljeni za sintezo substituiranih organskih spojin - kot izhajajo iz piridina - v formulaciji novih zdravil za izvajanje kemičnih transformacij, kot so umetna fotosinteza, za čiščenje vode iz težkih in škodljivih kovin in kot fotokatalitična sredstva.
Nanodelce je mogoče sintetizirati na biološki podpori, kot sta papaja in listi zelenega čaja, da se uporabijo kot antibakterijsko sredstvo.
Reference
- Scifun.org. (2018). Apno: kalcijev oksid. Okreval od: scifun.org.
- Wikipedija. (2018). Kalcijev oksid. Pridobljeno iz: v.Wikipedija.org
- Pubchem. (2018). Kalcijev oksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Shiver & Atkins. (2008). Anorganska kemija. V Elementi skupine 2. (Četrta izdaja., str. 280). MC Graw Hill.