Bonski oksid (B2O3) Kaj je, struktura, lastnosti, uporablja
- 3165
- 431
- Dexter Koch
On boronski oksid o Borični anhidrid je anorganska spojina, katere kemijska formula je B2Tudi3. Ker je elementi bora in kisika bloka P periodične tabele in še več glav njihovih skupin, razlika v elektronegativnosti med njimi ni zelo visoka; Zato je pričakovati, da je B2Tudi3 biti kovalentne narave.
B2Tudi3 Pripravimo ga z raztapljanjem boraksa v koncentrirani žveplovi kislini v pečici za združitev in pri temperaturi 750 ° C; Termično dehidriranje borove kisline, B (OH)3, pri temperaturi približno 300 ° C; ali pa se lahko oblikuje tudi kot produkt reakcije Diborano (B2H6) S kisikom.
Boro oksid ima lahko pol -transparenten ali kristalno steklo; Slednje z brušenjem lahko dobite v obliki prahu.
Čeprav se zdi, da to prvi pogled, se šteje B2Tudi3 kot eden najbolj zapletenih anorganskih oksidov; Ne samo s strukturnega vidika, ampak tudi zaradi spremenljivih lastnosti, ki jih steklo in keramika pridobita, do katere so dodani svoji matrici.
Struktura boro oksida
Enotnost bo3
B2Tudi3 To je kovalentna trdna snov, zato teoretično ne obstajajo v svoji strukturi iona B3+ niti2-, Toda povezave B-O. BORON, po Valenciji teorije povezav (TEV), lahko tvori le tri kovalentne povezave; V tem primeru tri povezave B-O. Posledica tega mora biti pričakovana geometrija trigonalna, Bo3.
Molekula BO3 Gre za slabi elektroni, zlasti atomi kisika; Vendar jih lahko več medsebojno komunicira, da bi priskrbelo omenjeno pomanjkanje. Tako trikotniki bo3 Pridružujejo se z deljenjem kisikovega mostu in se v vesolju distribuirajo kot trikotne mreže vrstic z njihovimi letali, usmerjenimi na različne načine.
Vam lahko služi: nenasičena rešitevKristalna struktura
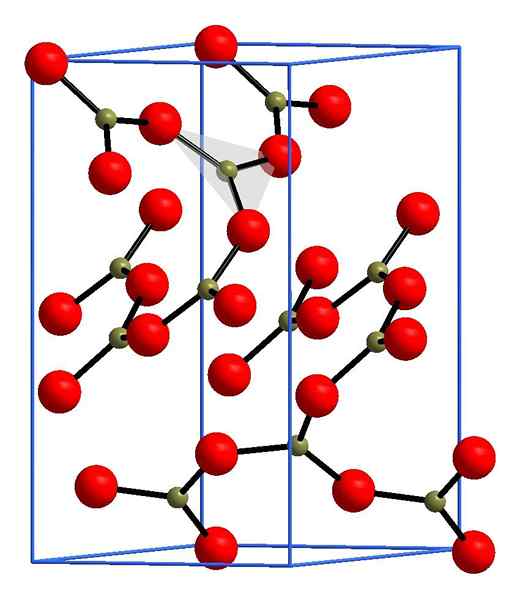
 Struktura boro oksida. Andif1, Wikimedia Commons.
Struktura boro oksida. Andif1, Wikimedia Commons. Na zgornji sliki je primer teh vrstic s trikotnimi enotami Bo3. Če ga opazimo previdno, vsi obrazi načrtov ne kažejo na bralca, ampak na drugo stran. Usmeritve teh obrazov so lahko odgovorne za to, kako je definiran B2Tudi3 pri določeni temperaturi in tlaku.
Ko imajo ta omrežja strukturni vzorec z dolgim obdobjem, je kristalna trdna snov, ki jo je mogoče zgraditi iz svoje enotne celice. Tu se reče, da je B2Tudi3 Ima dva kristalna polimorfa: α in β.
Α-B2Tudi3 Nastaja v zunanjem tlaku (1 atm) in pravi se, da je kinetično nestabilna; Pravzaprav je to eden od razlogov, zakaj je bonski oksid verjetno težka kristalizacijska spojina.
Drugi polimorf, β-B2Tudi3, V območju GPA dobijo visoki pritiski; Zato mora biti njegova gostota večja od gostote α-B2Tudi3.
Steklasta struktura
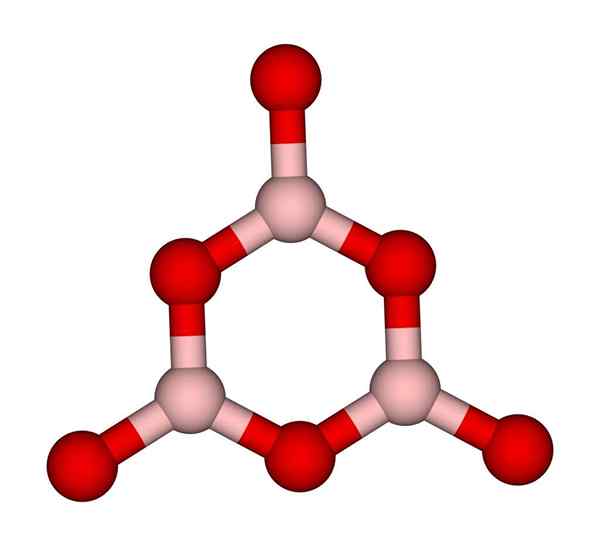 BOROXOL RING. Ccoil (pogovor). Wikimedia Commons.
BOROXOL RING. Ccoil (pogovor). Wikimedia Commons. Omrežja3 Seveda ponavadi sprejemajo amorfne strukture; To je, da nimajo vzorca, ki opisuje molekule ali ione v trdni snovi. S sintezo B2Tudi3 Njegova prevladujoča oblika je amorfna in ne kristalna; S pravilnimi besedami: je trdna bolj stekloma kot kristalna.
Nato se reče, da je B2Tudi3 Ko so vaši fantje Bo, je steklovito ali amorfno3 So neurejeni. Ne samo to, ampak tudi spremenite način, kako se pridružijo. Namesto da bi naročili v trigonalni geometriji, se bo borobni obroč (vrhunska slika) konča za ustvarjanje raziskovalcev (vrhunska slika).
Vam lahko služi: 20 primerov kemične energijeUpoštevajte očitno razliko med trikotnimi in šesterokotnimi enotami. Trikotna karakterizacija b2Tudi3 kristalno in šesterokotno2Tudi3 steklovino. Drug način za navajanje te amorfne faze je boronsko steklo ali s formulo: G-B2Tudi3 ('G' izvira iz besede steklena v angleščini).
Tako G-B omrežja2Tudi3 Sestavljajo jih iz borobnih obročev in ne enot BO3. Vendar G-B2Tudi3 se lahko kristalizira na α-b2Tudi3, kar bi pomenilo medsebojno pretvorbo obročev na trikotnike in določilo tudi stopnjo dosežene kristalizacije.
Lastnosti
Fizični videz
Je brezbarvna in steklena trdna. V svoji kristalni obliki je bela.
Molekularna masa
69.6182 g/mol.
Okus
Rahlo grenko
Gostota
-Kristalno: 2,46 g/ml.
-Steklovino: 1,80 g/ml.
Tališče
Nima popolnoma definirane fuzijske točke, ker je odvisno od tega, kako kristalna ali steklova. Čisto kristalna oblika se topi na 450 ° C; Vendar se oblika stekla topi v temperaturno območje, ki pokriva od 300 do 700 ° C.
Vrelišče
Ponovno se prijavljene vrednosti ne ujemajo s to vrednostjo. Očitno tekoči bonski oksid (staljen iz kristalov ali stekla) zavre pri 1860 ° C.
Stabilnost
Ohraniti mora biti suh, saj absorbira vlago, da se pretvori v borovo kislino, B (OH)3.
Nomenklatura
Boro oksid lahko poimenujemo na druge načine, na primer:
-Diboro trioksid (sistematična nomenklatura).
-Bonski oksid (III) (nomenklatura zalog).
-Borični oksid (tradicionalna nomenklatura).
Prijave
Nekatere uporabe borovega oksida so:
Sinteza boro trihalogenuros
Od b2Tudi3 lahko sintetizira trihalogenuros de boro, bx3 (X = f, cl y br). Te spojine so Lewisove kisline, z njimi.
Lahko vam služi: poliatomski ioni: seznam in vajeInsekticid
Trdna mešanica z borovo kislino, b2Tudi3-B (OH)3, predstavlja formulo, ki se uporablja kot domači insekticid.
Topilo kovinskih oksidov: nastajanje stekla, keramika in zlitine bora
Tekoči oksid lahko raztaplja kovinske okside. Iz te dobljene mešanice, ko se ohladi, dobimo trdne snovi, sestavljene iz bora in kovin.
Odvisno od količine B2Tudi3 Uporablja se tudi tehnika in vrsta kovinskega oksida, bogato raznolikost stekla (borosilikati), keramiko (nitridi in borovi karbidi) in zlitine lahko dobite (če se uporabljajo samo kovine).
Na splošno stekla ali keramika pridobijo večjo odpornost in moč ter tudi večjo trajnost. V primeru stekla se na koncu uporabljajo za optične in teleskopske leče ter za elektronske naprave.
Vezavo
Pri konstrukciji jeklenih livarnih pečic se uporabljajo ognjevzdržne opeke z magnezijem. V njih se kot vezivo uporablja boronski oksid, ki jim pomaga, da jih močno združijo.
Reference
- Borični oksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Borix oksid. 20 Mule Team Borax. Obnovi se od: borax.com

