Žveplov oksid
- 3421
- 1063
- Dexter Koch
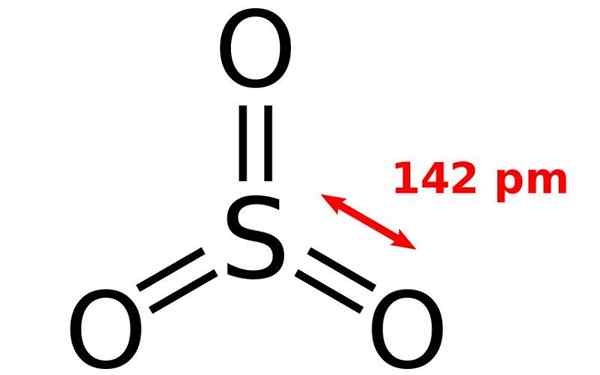
 Kemična struktura molekule žveplovega oksida. Vir: Joel Holdsworth, Wikimedia Commons
Kemična struktura molekule žveplovega oksida. Vir: Joel Holdsworth, Wikimedia Commons Kaj je žveplov oksid?
On žveplov oksid (Vi), znan tudi kot žveplo ali žveplov anhidridni trioksid, je kemična spojina formule S3, To je v normalnih pogojih brezbarvna in vlaknasta trdna snov, pri 25 ° C in 1 atm.
Žveplov trioksid nastane z oksidacijo žveplovega oksida.
Do zdaj pa edina čista žveplova trioksidna priprava iz plinov, ki vsebujejo3 razredčen, je bil postopek na pilotski rastlinski lestvici, ki pomeni krioskopsko kondenzacijo.
Običajni postopek pomeni destilacijo olja. Toplota, potrebna za oljno destilacijo, bolj priročno dobavlja vroče kontaktne pline iz pripadajoče rastline žveplove kisline.
V laboratoriju ga lahko pripravimo s segrevanjem kajenja žveplove kisline in zbiranjem sublimiranega v ohlajenem sprejemniku. Če je para kondenzirana nad 27 ° C, se oblika gama dobi kot tekočina.
Če je para kondenzirana pod 27 ° C in v prisotnosti vlažnosti, dobimo mešanico treh oblik. 3 oblike lahko ločimo z delno destilacijo.
Fosilno kurjenje goriva je vzrok za njegov videz v atmosferi, kar je glavni antropogeni vzrok.
Fizikalne in kemijske lastnosti žveplovega oksida
- Žveplov trioksid je oblikovan kot bele igle, ki postanejo dim v zraku. Pogosto naletite na zaviralce, da se izognete polimerizaciji.
Vam lahko služi: Renio: odkritje, lastnosti, struktura, uporabe- Njegova molekulska teža je 80.066 g/mol, njegova gostota je 1,92 g/cm³ g/ml, točke fuzije in vrelišča pa 16,8 ° C in 44,7 ° C.
- Spojina je kombinirana z vodo z eksplozivno silo, ki tvori žveplovo kislino zaradi kislosti. Organske snovi Carboniza žveplovega trioksida.
- Žveplov trioksid hitro absorbira vlago in oddaja goste bele hlape. Raztopine trioksida žveplove kisline se imenujejo kajenje žveplove kisline ali olja.
- Reakcija žveplovega trioksida in difluorid s kisikom je zelo živahna in nastane eksplozije, če reakcija izvede v odsotnosti topila.
- Prekomerna reakcija trioksida s tetrafluoroetilenom povzroči eksplozivno razgradnjo karbonilnega fluorida in žveplovega dioksida.
- Reakcija brezvodne perklorne kisline z žveplovim trioksidom je nasilna in jo spremlja evolucija precejšnje toplote. Tekoči žveplov trioksid silovito reagira z nitrilnim kloridom, celo 75 ° C.
- Reakcija žveplovega trioksida in svinčevega oksida povzroča belo luminiscenco. Kombinacija joda, piridina, žvepla in formamidnega trioksida je po nekaj mesecih razvila plin ob tlaku.
To je posledica počasne tvorbe žveplove kisline, zunanje vode ali dehidracije vodikovega cianidnega formamida.
Tveganja
Žveplov trioksid je stabilna spojina, nezdružljiva z organskimi materiali, kovinami v prahu, bazami, voda, cianidi in najrazličnejšimi drugimi kemikalijami.
Snov je močan oksidant in silovito reagira z gorljivimi materiali in organizatorji ter organskimi spojinami, ki povzročajo nevarnost požara in eksplozije.
Vam lahko služi: natrijev oksalat (NA2C2O4): struktura, lastnosti, uporabe, tveganjaSilovito reagira z mokro vodo in zrakom, da proizvaja žveplovo kislino. Raztopina v vodi je močna kislina, silovito reagira z bazami in jedkimi kovinami, ki tvori vnetljiv / eksploziven plin.
Spojina je jedska za kovine in tkiva. Povzroči opekline v očeh in koži. Zaužitje povzroča hude opekline v ustih, požiralnik in želodec. Para je z vdihavanjem zelo strupena.
V primeru očesnega stika morate preveriti, ali se kontaktne leče uporabljajo in jih takoj odstranite. Oči je treba vsaj 15 minut sprati s tekočo vodo, pri čemer so veke odprte. Lahko uporabimo hladno vodo, ne da bi nanesili očesno mazilo.
Če kemikalija pride v stik z oblačili, jo čim hitreje zadržite in zaščitite svoje roke in telo. Žrtev postavite pod varnostno prho.
Če se kemikalija nabira v izpostavljeni koži žrtve, kot so roke, se koža, onesnažena s tekočo vodo, in ne -Babrazivno milo mehko oprana in previdno. Lahko uporabimo hladno vodo. Če draženje traja, poiščite zdravniško pomoč. Operite onesnažena oblačila, preden jih ponovno uporabite.
V primeru vdihavanja je treba žrtev dovoliti, da stoji na dobro prezračenem območju. Če je vdihavanje resno, je treba žrtev čim prej evakuirati na varno območje. Ohlapna tesna oblačila, kot so vrat srajce, pasovi ali kravata.
Če je žrtev težko dihati, je treba dajati kisik. Če žrtev ne diha, je narejena oživljanje ust. Vedno upoštevamo, da je lahko nevarno za osebo, ki nudi pomoč pri oživljanju ust do ust, kadar je vdihani material strupen, nalezljiv ali koroziven.
Lahko vam služi: hipofiza (H3PO2): lastnosti, uporabe in reagentiV vseh primerih je treba iskati takojšnjo zdravniško pomoč.
Po drugi strani je onesnaževanje zraka zaradi žveplovih oksidov pomemben okoljski problem, saj se v atmosfero vsako leto oddajajo milijoni ton žveplovega dioksida in trioksida. Te spojine so škodljive za rastlinsko in živalsko življenje, pa tudi za številne gradbene materiale.
Druga velika težava je, da je kisli dež. Oba žveplovi oksidi se raztopijo v atmosferskih kapljicah vode, da tvorijo kislinske raztopine, ki so lahko zelo škodljive, ko padejo v obliki dežja.
Kisli dež lahko poškoduje gozdove in povzroči, da ribe umrejo v mnogih jezerih. Jed je tudi za kovine, apnenca in druge materiale. Možne rešitve tega problema so drage zaradi težav pri odpravljanju žvepla premoga in nafte.
Prijave
- Žveplov trioksid je bistveni reagent v reakcijah sulfoniranja. Ti procesi zagotavljajo detergente, barvila in farmacevtske izdelke. Nastaja in situ iz žveplove kisline ali se uporablja kot raztopina žveplove kisline za kajenje.
- Njegove razkužilne lastnosti so odgovorne, da se stoletja uporabljajo za razkuževanje vinskih kock, kurjenje žvepla v njih.
Reference
- Trioksidni žveplo. Okreval od EBI.AC.Združeno kraljestvo
- Varnostni podatkovni list žveplov trioksid. Okrevano iz Sciencelaba.com

