Struktura aluminijevega oksida, lastnosti, uporabe, nomenklatura
- 1475
- 56
- Cary Goyette
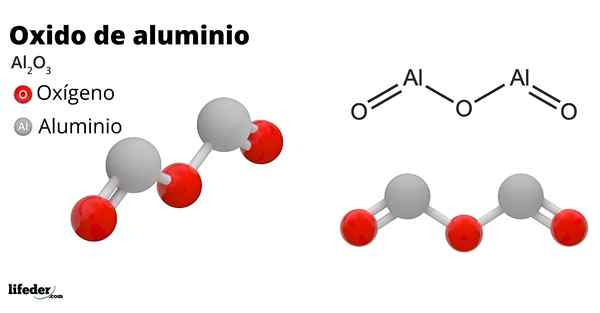
On Aluminijev oksid, Imenuje se tudi aluminije, aluminijev oksid, Corindon ali aluminijev trioksid, je anorganska spojina, katere kemijska formula je za2Tudi3. To je amfotero oksid, čeprav lahko zaradi zdravljenja postane skoraj inertna spojina.
Ima veliko trdoto, korozijsko odpornost in visoko električno upornost. Te lastnosti so med drugim omogočile številne aplikacije aluminijevega oksida, kot so: električna izolacija, abrazivni material, vsadki kosti in zob itd.
Bauksit je glavni vir za pridobivanje aluminijevega oksida. Corindon je na drugi strani mineral aluminijevega oksida, ki je v prostem stanju v obliki α-Al2Tudi3. Corindon ima trdoto 9.0, in zaradi nekaterih nečistoč proizvaja dragocene kamne, kot sta safir in rubina.
Elektroliza aluminijevega oksida je služila kot osnova za izolacijo aluminija s strani Humphryja Davyja leta 1808. Ta ista metoda se z nekaterimi prilagoditvami trenutno uporablja v proizvodnji kovinskega aluminija.
[TOC]
Struktura
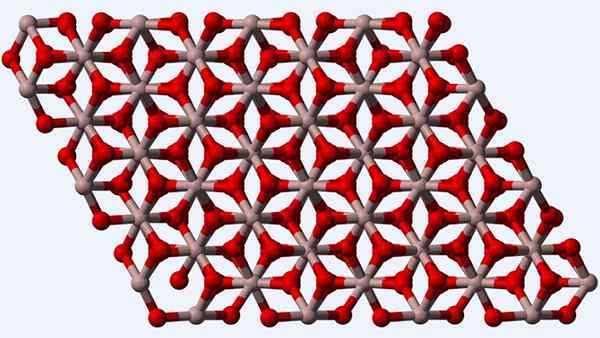 Kristalna struktura faze α-Al2O3 ali Corindon
Kristalna struktura faze α-Al2O3 ali Corindon Corindon ali α-al faza2Tudi3, Ker je termodinamično bolj stabilen polimorf za aluminijev oksid, njegova struktura (vrhunska slika) velja za glavno v času njegove karakterizacije. Ta struktura je trigonalna, z ioni3+ obkroženo s šestimi oz2-, in zato vzpostavitev oktaedros al6 z interakcijami al-o al-o.
Poleg Corindón, al2Tudi3 Obstaja tudi kot drugi metastabilni polimorfi, vključno z: γ-al2Tudi3 in η-al2Tudi3 (kubično), θ-at2Tudi3 (monoklinic), χ-al2Tudi3 (šesterokotni), κ-al2Tudi3 (Ortorrombic) in Δ-al2Tudi3 (Tetragonalno ali ortorrombično).
Kot al2Tudi3, Oktahedre se "lomijo" v Tetrahedrosu al4 O Pentaedros Alo5. Ko se enkrat stopijo in se spet ohladite, lahko dobite steklovi aluminijev oksid, torej amorfni, z mešanicami poliedre alm5 in vse6.
Lahko vam služi: Einstenio (S): struktura, lastnosti, pridobivanje, uporabeLastnosti aluminijevega oksida
 Aluminijevi oksidni prevleki staljeni kovinski aluminijasti kosi
Aluminijevi oksidni prevleki staljeni kovinski aluminijasti kosi Fizični videz
Trden ali bel kristalni prah
Molarna masa
101.96 g/mol
Vonj
Stranišče
Gostota
3.798 g/cm3
Tališče
2072 ° C
Vrelišče
2977 ° C
Topnost
Netopna v vseh topilih, vključno z vodo.
Toplotna prevodnost
30 W · m-1· K-1. Kljub uporabi keramike ima razmeroma veliko toplotno prevodnost.
Lomni količnik
1.768-1.760
Trdota
To je spojina, ki predstavlja zelo visoko trdoto, z vrednostjo 9.0 na lestvici trdote MOHS v obliki α-aluminijevega oksida (Corindón).
Električna upornost
Pri 300 ° C: 1.2 x 1013 Ohmi · cm. Aluminijev ali aluminijski oksid je torej električni izolator.
Reaktivnost
Al2Tudi3 Kljub šibkemu odzivanju z alkaliji in v večji meri s kislinami velja za kemični amfoter. Ko pa se segreje pri več kot 800 ° C, pridobi skoraj inertno stanje delovanja kislin.
Ta oksid je odgovoren za zaščito aluminija pred okoljskimi korozivnimi sredstvi, saj trdno pokriva površino kovine brez drobljenja ali razpoka.
Nomenklatura
Nomenklatura al2Tudi3 Preprosto je. Sistematično znan kot diauminijski trioksid. Ker ta aluminijev oksid obstaja, v svoji nomenklaturi kovine Valencia (III) ni določena. Prav tako je njegovo ime tradicionalno povzeto na aluminijevi oksid, tako da ima samo eno valenco.
Uporaba/aplikacije
Kozarec
Aluminijevi oksid se vmeša v izdelavo stekla iz aluminija-silicato. To ognjevzdržno steklo, odporno na toplotni udar, se lahko uporablja pri višjih temperaturah kot boronsko-silikatno steklo; Čeprav ima nižjo kemično odpornost.
Dodajanje majhne količine magnezije pretvori neprozorno steklo glinice v prosojnik, ki ga je mogoče uporabiti kot zabojnik za plin v žarnici natrijeve visokotlačne pare. Uporablja se tudi pri pripravi suspenzij premazov nekaterih vrst fluorescentnih svetilk.
Vam lahko služi: rodio: zgodovina, lastnosti, struktura, uporabe, tveganjeKatalizator
Aktivna alumina ima zrnato in porozno značilnost, ki ima lahko katalitično aktivnost, ali služi kot podpora aktivnosti drugih katalizatorjev. Med drugimi procesi se alumina vmeša v katalizo polimerizacije etilen oksida.
Mikrobicidna aktivnost
Delci nano-aluminijevega oksida se prilepijo na površino bakterij, kar povzroča njihovo smrt. Prav tako je bil dokazan podoben vpliv na glivo rodu kandide.
Električni izolator
Aluminijev oksid ima visoko električno upornost, kar mu daje sposobnost, da deluje kot električni izolator. Zato se uporablja v integriranih paketih vezja. Uporablja se tudi v superprevodniških napravah in kot dielektrični kondenzator ali kondenzatorji. Poleg tega se uporablja kot izolator v električnih svečkah.
Abrazivno
 Corindon, kristalni in strožji aluminijevega oksida, služi za izgradnjo abrazivnih orodij. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, prek Wikimedia Commons
Corindon, kristalni in strožji aluminijevega oksida, služi za izgradnjo abrazivnih orodij. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, prek Wikimedia Commons Visoka trdota minerala Corindon omogoča, da se uporablja kot abraziv, manj stroški kot diamanti, v industriji in pri vrtanju nafte.
Corindon pridobi obliko dragocenega kamna, kot je Rdeča rubina, zaradi kromirane kontaminacije; ali kot modri safir zaradi onesnaževanja z železom in titanom. Številne vrste brusnega papirja, ki se uporabljajo v kovini in lesu, imajo kristale aluminijevega oksida.
Trdoživost ali sposobnost, da se izognete rupturi aluminijevega oksida, se poveča z dodajanjem cirkonija ali silicijevega karbida, kar omogoča, da se uporablja v industrijskih orodjih rezanja. Poleg tega se v zobnih kremah za poliranje zob uporablja aluminijev oksid.
Vam lahko služi: cinkov kromat: struktura, lastnosti, pridobivanje, uporabeTudi nekatere predstavitve aluminijevega oksida uporabljajo kot abrazivi pri zdravljenju nekaterih kožnih stanj.
Dehumidifikator plina
Aluminijev oksid je spojina z AVID z vodo, zato ga lahko uporabimo za izvlečenje iz plinastih tokov.
Negorljive
Nano delci hidroksida aluminijevega oksida (Bohemita) delujejo kot disipator toplote, sproščajo vodo in zamujajo videz plamena.
Vsadki trdega tkiva
Aluminijev oksid je spojina velike trdote, kemično inerten in korozijsko odporen, poleg tega pa ima belo barvo. Za te lastnosti se uporablja kot nadomestek za trda tkiva, kot so kosti in zobje. Prav tako je bil v zamenjavi sklepov uporabljen material, zgrajen z aluminijevim oksidom.
Pridobivanje
 Vzorec boksita. Vir: Max.Kit, cc by-sa 4.0, prek Wikimedia Commons
Vzorec boksita. Vir: Max.Kit, cc by-sa 4.0, prek Wikimedia Commons Biksit je glavni mineral za pridobivanje aluminijevega oksida, ki nastane z mešanico treh mineralov: Gibbsite, Laboehmita in diaspora.
Aluminijev oksid izvleče iz njegovih mineralov po Bayerjevem postopku. To je sestavljeno iz vroče reakcije boksita z natrijevim hidroksidom, reakcije, ki jo proizvaja natrijev aluminat [naal (OH)4].
Ko se prejšnja raztopina ohladi, se v trdni obliki nastajajo padavine aluminijevega hidroksida. Nato se ta hidroksid segreje do 1100 ° C, ki proizvaja aluminijev oksid.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Oksidni aluminij. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Oksidni aluminij. Pubchem Comunund Povzetek za CID 9989226. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kushagri s. et al. (2019). Protivirusna in protimikrobna potencial nano zdravil: nanodelci aluminijev oksid. Pridobljeno iz: SCINCEDIRECT.com
- Uredniki Enyclopeedia Britannica. (2020). Alumina. Okrevano od: Britannica.com
- Lohninger Hans. (15. avgust 2020). Oksidni aluminij. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Aromatični elektrofilni mehanizem substitucije in primeri
- 30 primerov etike in morale v vsakdanjem življenju »

