Aromatični elektrofilni mehanizem substitucije in primeri

- 5065
- 531
- Ricky Dach
The Aromatična elektrofilna substitucija (SEAR) To je organska reakcija, pri kateri slaba vrsta v elektroni, torej elektrofijo, nadomešča enega od vodikov aromatičnega obroča. Ta reakcija nasprotuje dodatki, ki jih utrpijo alkeni, kar kaže na učinek aromatičnosti na reaktivnosti benzena in njenih derivatov.
Elektrofil, večkrat, nastane med istim molekularnim mehanizmom, produktom mešanice reagentov in katalizatorja, ki ga sestavlja kislina Lewis, na primer vsi3 ali fecl3. Ti katalizatorji povečajo avidnost elektrofila z elektroni aromatičnega obroča in s tem pospešijo reakcijo.
 V aromatični elektrofilni substituciji je benzenski obroč, ki napade elektrofil. Vir: Gabriel Bolívar prek Molview.
V aromatični elektrofilni substituciji je benzenski obroč, ki napade elektrofil. Vir: Gabriel Bolívar prek Molview. Na vrhunski sliki imamo preprost prikaz elektrofilnega napada benzena proti elektrofilu in+. Upoštevajte, da napad izvira iz elektronov ene od njegovih dvojnih vezi; to pomeni, da začnejo elektroni konjugiranega π sistema.
Ta reakcija omogoča, da benzen in druge aromatične spojine pridobijo substituente, kot so skupine OH, ne2, SW3H, CL, BR, R, Cor, Coch3, med ostalimi. Na primer, fenol se sintetizira s pomočjo Benzena in drugih derivatov.
[TOC]
Aromatični elektrofilni mehanizem nadomestitve
1. korak: Elektrofilni napad
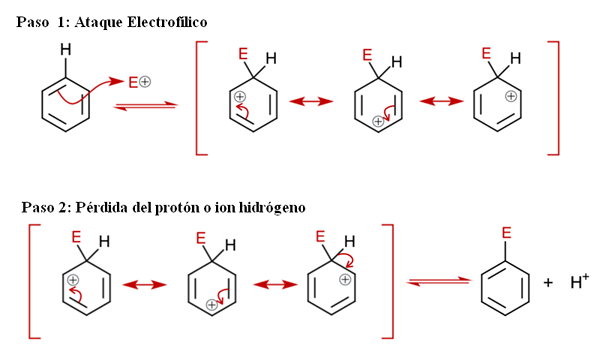 Splošni mehanizem za SEAR. Vir: Soonlorpai prek Wikipedije.
Splošni mehanizem za SEAR. Vir: Soonlorpai prek Wikipedije. Na vrhunski sliki je mehanizem aromatične elektrofilne substitucije podrobneje predstavljen. Katera od treh dvojnih vezi benzena napade elektrofil in+, Da bi tvorili posredniško vrsto, znano kot ion arenio (delokalizirani cikloheksadien), zaklenjena v rdeče oklepaje.
Vam lahko služi: kemične padavineUpoštevajte, da pozitivna obremenitev E+ Zdaj se premaknite v notranjost obroča. Ampak ne samo to: preseli se med tremi ogljikovimi atomi v orto (sosednjih) položajih in za (nasprotno) z ogljikom, povezanim z E (C-E). Ta posrednik obstaja prav zaradi stabilnosti, ki jo podeljujejo njene resonančne strukture.
2. korak: Izguba protonskega ali vodikovega iona
Vendar mora arenio ion kmalu nevtralizirati svojo pozitivno obremenitev z izgubo vodikovega protona ali iona. Tu je vrhunec vrhunec. Elektrofil e+ Zato nadomesti enega od benzenskih vodikov, tako da to pusti kot ion h+ zunaj obroča, tako da se ohranijo pozitivni naboji.
Če ga opazimo previdno, so vsi koraki v ravnovesju, zato je zamenjava reverzibilna. To je, če se koncentracije h povečajo+, Potem bo vodik nadomestil E in spet bomo dobili reagente.
Primeri aromatične elektrofilne substitucije
Benzen
Benzenski sear je najpreprostejši od vseh, ki so že zastopani zgoraj. Katerega koli vodika lahko nadomestimo z E+, Ker so vsi kemično enakovredni.
Med seboj ni razlik. Zato je verjetnost, da se zamenjava pojavi v enem od šestih atomov ogljika. Vendar se vse spremeni, ko so v benzenskem obroču prisotni drugi substituenti, kot bomo videli spodaj.
Fenol
Ortho, za napade in ciljni napadi
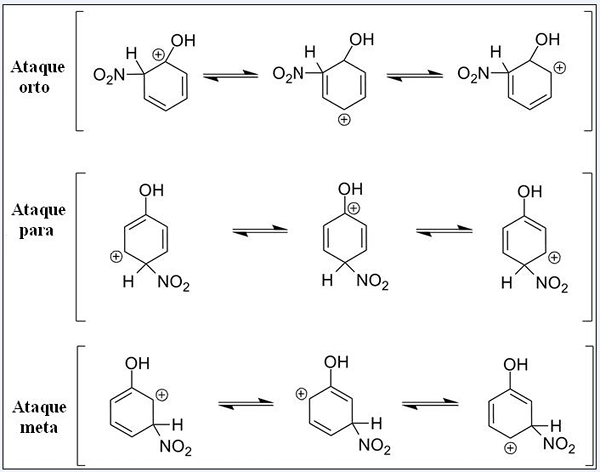 Resonančne strukture za fenol v reakciji aromatične elektrofilne substitucije. Vir: Pete Davis, javna domena, prek Wikimedia Commons
Resonančne strukture za fenol v reakciji aromatične elektrofilne substitucije. Vir: Pete Davis, javna domena, prek Wikimedia Commons Razmislite zdaj o fenolu. Tokrat je elektrofija nitronska kation, ne2+, ki se pri povezavi z benzenskim obročem spremeni v skupino nitro2.
Vam lahko služi: nitrati: lastnosti, struktura, nomenklatura, usposabljanjeZdaj, ko je prisotna skupina OH, drugi vodiki prenehajo biti kemično enakovredni; Nekateri so bolj dovzetni za zamenjavo kot drugi. In poleg tega na tej točki neposredno vpliva.
Zgoraj imamo tri substitucije v različnih položajih, povezanih z napadi OH: Ortho, za in cilje. Upoštevajte, da imamo v vseh treh peščeni kation in njegove resonančne strukture. V napadih Ortho je pozitivna obremenitev znotraj benzenskega obroča nameščena tik v ogljiku, povezanem z OH; Medtem ko se v ciljnem napadu to ne zgodi.
Oh kot orto skupino in za direktorja
Oh predstavlja sposobnost donosa elektronov na obroč z resonanco in indukcijo. V obeh lahko pomaga "raztresti" pozitivno obremenitev v ogljiku, s katerim je povezan, in ustrezno stabilizira strukturo. Nasprotno, ko se ciljni napad zgodi, OH ne more stabilizirati pozitivne obremenitve na enak način, struktura je bolj nestabilna.
Zato so Ortho napadi in za več energije. Nato se reče, da je OH orto-za režiserjeva skupina, ki lahko aktivira tudi benzenski obroč proti Searju. To pomeni, da fenol reagira veliko hitreje kot benzen, kar je dokazano z merjenjem reakcijskih hitrosti.
Arilamini
 Resonančne strukture za anilin v reakciji aromatične elektrofilne substitucije. Vir: V8Rik pri angleški Wikipediji, CC BY-SA 3.0, prek Wikimedia Commons
Resonančne strukture za anilin v reakciji aromatične elektrofilne substitucije. Vir: V8Rik pri angleški Wikipediji, CC BY-SA 3.0, prek Wikimedia Commons Primer arinaminov, kot je anilin (nadrejena slika), je podoben kot pri fenolu. Upoštevajte, da je tokrat v svojem mehanizmu stabilizacija pozitivne obremenitve na dušikovem atomu (H2N+=), pomoč, da se substitucija usmeri v Orto položaj in za, kot pri OH.
Lahko vam služi: kisline teorije: Arrhenius, Bronsted-Lowry, LewisZdaj je anilin bolj reaktiven kot fenol proti elektrofilni substituciji. Ker? Ker je atom dušika manj elektronegativen kot kisik, zato lažje daje svoj par prostih elektronov do aromatičnega obroča. Kisik, ker je bolj elektronegativen, daje enega od svojih elektronskih parov z manj "avidity".
Tudi atomski polmer dušika je po velikosti bližje kot pri ogljiku. To vpliva na dejstvo, da resonanca poteka zlasti med atomi s podobnimi radijskimi sprejemniki ali velikosti. Zato je resonanca med ogljikom in dušikom nekoliko bolj stabilna in učinkovita od tiste med ogljikom in kisikom.
Klorobenzen
V klorobenzenu na drugi strani atom CL upočasni zamenjavo zaradi svoje elektronegativnosti. In čeprav lahko tudi zaradi resonance obroča podari tudi elektrone, je njegov atomski polmer bistveno večji kot pri ogljiku, zato zmanjšuje omenjeni elektronski prispevek.
Kot odgovor je klorobenzen reagiral 50 -krat počasnejši od benzena, saj je njegov obroč deaktiviran zaradi klora. In tudi privabljanje elektronov k sebi je klor ciljna skupina, tako da se bodo v tem položaju pretežno pojavile zamenjave.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Aromatična spojina. Pridobljeno iz: v.Wikipedija.org
- Ed Vitz in sod. (8. septembra 2020). Aromatični ogljikovodiki. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wyman Elizabeth. (2020). Aromatični ogljikovodiki: definicija, primer in uporaba. Študij. Okrevano od: študij.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). Kemična zapletenost avtomobilskega bencina. Znanost, inženiring in aplikacije,2(2), 51–79. Doi: doi.org/10.22206/Cyap.2019.V2i2.PP51-79
- « Značilnosti toplotne energije, pridobivanje, prenos
- Struktura aluminijevega oksida, lastnosti, uporabe, nomenklatura »

