Voltamperometrija
- 2195
- 402
- Adrian Legros
 Voltamperometry je elektrokemijska metoda, ki meri tok elektrode
Voltamperometry je elektrokemijska metoda, ki meri tok elektrode Kaj je voltamperometry?
The voltamperometrija To je elektroanalitična tehnika, ki določa informacije iz kemijskih ali analitnih vrst iz električnih tokov, ki nastanejo zaradi variacije uporabnega potenciala. To pomeni, da so potencialni E (v) uporabljeni in čas (t) neodvisne spremenljivke; Medtem ko je tok (a), odvisna spremenljivka.
Kemične vrste morajo biti običajno elektroaktivne. To pomeni, da mora izgubiti (oksidirati) ali zmagati (zmanjšati) elektrone. Da se reakcija sproži, mora delovna elektroda teoretično zagotoviti potrebno potencialno enačbo z Nernstovo enačbo.
Ta metoda se med drugim pogosto uporablja v anorganski, biokemiji in fizikalni kemiji, zlasti za analizo oksidacije, redukcije ali adsorpcijske procese.
Kako deluje voltamperometry?
Voltamperometrija je bila razvita zaradi izuma Nobelove kemije iz leta 1922, Jaroslav Heyrovsky (1890-1967). V njej se elektroda za kapljico živega srebra (EGM) nenehno obnavlja in polarizira.
Takrat so bile rešene analitične pomanjkljivosti te metode z uporabo in oblikovanjem drugih mikroelektrod. Te se zelo razlikujejo od materiala, iz premoga, plemenite kovine, diamantov in polimerov, tudi v njegovem dizajnu, diskih, jeklenkah, listih; In poleg tega na način, kako komunicirajo z rešitev: stacionarno ali rotacijsko.
Vse te podrobnosti so namenjene1). To je sorazmerno s koncentracijo analita in polovico moči E (e (e1/2) doseči polovico tega toka (i1/2) je značilno za vrsto.
Torej, določitev vrednosti e1/2 V krivulji, kjer je tok, pridobljen z variacijo E je graf, imenovan voltamperaogram, Prisotnost analita je mogoče prepoznati. To pomeni, da bo vsaka analit glede na pogoje eksperimenta imela svojo vrednost E1/2.
Vam lahko služi: točka enakovrednostiVoltamperometrični val
V voltamperometriji sodelujemo s številnimi grafi. Prva je krivulja E proti. t, kar vam omogoča spremljanje možnih razlik, uporabljenih kot funkcija časa.
Toda hkrati električni vezje zabeleži vrednosti C, ki jih analit proizvede pri izgubi ali pridobivanju elektronov v bližini elektrode.
Ker je elektroda polarizirana, je mogoče manj analita razširiti iz vrtine raztopine do nje. Na primer, če ima elektroda pozitiven naboj, vrsta x- To ga bo pritegnilo in ga bo vodil za zgolj elektrostatično privlačnost.
Toda x- ni sam: v vašem okolju so prisotni drugi ioni. Nekaj kationov m+ Lahko ovirajo pot do elektrode, tako da jo najdejo v "grozdih" pozitivnih nabojev; In tudi anioni n- Lahko jih ukrademo okoli elektrode in preprečimo x- Pridem do njega.
Vsota teh fizičnih pojavov povzroči izgubo toka in to opazimo v C proti. E in njegova oblika, podobna obliki A, imenovana sigmoidna oblika. Ta krivulja je znana kot voltamperometric val.
Instrumentacija
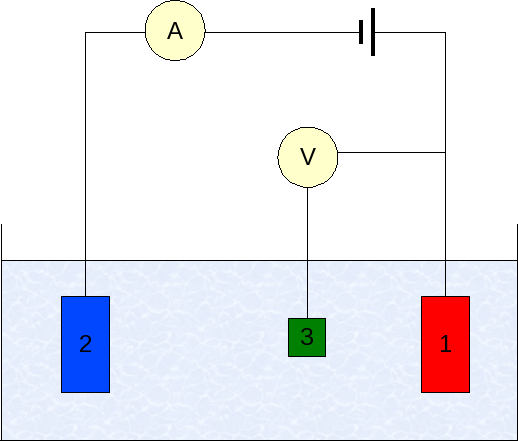 Elektrode v voltamperometriji. Vir: Wikimedia Commons
Elektrode v voltamperometriji. Vir: Wikimedia Commons Instrumentacija voltamperometrije se razlikuje glede na analit, topilo, vrsto elektrode in aplikacije. Toda velika večina jih temelji na sistemu, sestavljenem iz treh elektrod: eno od dela (1), pomožnega (2) in reference (3).
Glavna referenčna elektroda je elektroda Calomenanos (ECS). To skupaj z delovno elektrodo omogoča vzpostavitev potencialne razlike ΔE, saj potencial referenčne elektrode med meritvami ostane konstanten.
Vam lahko služi: Selenium: Zgodovina, lastnosti, struktura, pridobivanje, uporabePo drugi strani je pomožna elektroda odgovorna za nadzor obremenitve, ki prehaja na delovno elektrodo, da jo ohrani v sprejemljivih vrednostih. Neodvisna spremenljivka, uporabljena potencialna razlika, je tista, ki jo dobimo z vsoto potencialov delovnih elektrod in referenco.
Vrste voltamperometrije
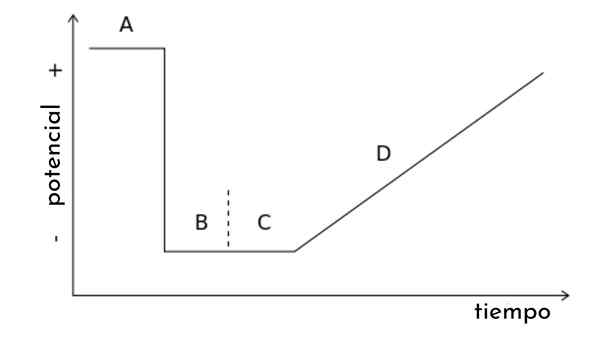
Na sliki članka je prikazan graf. T, imenovan tudi potencialni val za linearno skeniranje voltamperometry.
Vidimo, da se s časom potencialni poveča. Po drugi strani ustvari krivuljo odgovorov ali voltamperaogram C vs. E, katere oblika bo sigmoidna. Točka bo prišla tam, kjer se ne glede na to, kako se povečuje.
Iz tega grafa je mogoče sklepati na druge vrste voltamperometrije, s čimer se spreminja potencialni val. t z nenadnimi potencialnimi impulzi po določenih vzorcih. Vsak vzorec je povezan z vrsto voltamperometrije in zajema lastno eksperimentalno teorijo in pogoje.
Impulzna voltamperometrija
Pri tej vrsti voltamperometrije lahko analizirate mešanice dveh ali več analitov, katerih e e1/2 sta si zelo blizu drug drugemu.
Tako analit z e1/2 od 0.04V je mogoče identificirati v družbi drugega z e1/2 od 0.05V. Medtem ko je v linearnem skeniranju voltamperometry, mora biti razlika večja od 0.2V.
Zato obstajajo večje meje občutljivosti in nižje; to pomeni, da je mogoče analize določiti pri zelo nizkih koncentracijah.
Potencialni valovi imajo lahko podobne vzorce kot stopnice, nagnjene stopnice in trikotnike. Slednje ustreza ciklični voltamperometriji (CV).
Vam lahko služi: omejevanje in prekomerni reagentV življenjepisu potencial in v določenem smislu veljajo, pozitivni ali negativni, nato pa se v določeni vrednosti E v času istega potenciala, vendar v nasprotnem smislu. Pri preučevanju ustvarjenih voltampeogramov maksimumi razkrijejo prisotnost posrednikov v kemični reakciji.
Ponovna voltamperometrija
To je lahko anodnega ali katodnega tipa. Sestavljen je iz elektrodepozicije analita na živosrebnem elektrodi. Če je analit kovinski ion (kot CD2+), oblikovan bo amalgam; In če gre za anion (kot Moo42-), netopna živo srebrna sol.
Nato se uporabijo potencialni impulzi za določitev koncentracije in identitete vrst elektrodepos. Tako je amalgam ponovna, tako kot živo srebro soli.
Uporaba voltamperometry
- Za določitev koncentracije kovin, raztopljenih s tekočino, se uporablja anodna ponovitev voltamperometrije.
- Omogoča preučevanje kinetike redoks ali adsorpcijskih procesov, zlasti kadar so elektrode spremenjene za odkrivanje specifičnega analita.
- Njegova teoretična osnova je služila za izdelavo biosenzorjev. S temi lahko določimo prisotnost in koncentracija bioloških molekul, beljakovin, maščob, sladkorjev itd.
- Končno zazna sodelovanje posrednikov v reakcijskih mehanizmih.
Reference
- González m. (2010). Voltamperometrija. Okrevano od: Kemija.Laguia2000.com
- Kemija in znanost (2011). Voltamperometrija. Pridobljeno iz: thequimica andlaciencia.Blogspot.com
- Quiroga a. (2017). Ciklična voltammetrija. Okrevano od: kem.Librettexts.org
- Samuel P. Kouves (s.F.). Voltammetrične tehnike. [PDF]. Univerza Tufts. Okreval od: rjava.Edu
- Dan r. & Underwood a. Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall.

