Zgodovina volframa, lastnosti, struktura, uporabe

- 2209
- 569
- Raymond Moen
On Volfram, Wolframio ali Volframium je težka prehodna kovina, katere kemični simbol je w. Nahaja se v obdobju 6 s skupino 6 periodične tabele, njegovo atomsko število pa 74. Njegovo ime ima dva etimološka pomena: trdi kamen in volk pena; Drugo je, ker je ta kovina znana tudi kot Wolframio.
To je srebrna siva kovina in četudi je krhek, ima veliko trdoto, gostoto ter visoko zlivanje in vrelišča. Zato je bil uporabljen v vseh tistih aplikacijah, ki vključujejo visoke temperature, tlake ali mehanske sile, kot so vaje, izstrelke ali sevanje.
 Volframova palica z delno oksidirano površino. Vir: Hi-res slike kemičnih elementov [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]
Volframova palica z delno oksidirano površino. Vir: Hi-res slike kemičnih elementov [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] Najbolj znana uporaba te kovine, na kulturi in priljubljeni ravni, je v nitkah električnih žarnic. Kdo jih je manipuliral, bo spoznal, kako krhki so; Vendar pa niso narejeni iz čistega volframa, ki je popljiv in duktilni. Poleg tega v kovinskih matricah, kot so zlitine, zagotavlja odlično odpornost in trdoto.
Zanj je značilno in razlikovano tako, da je kovina z najvišjo fuzijsko točko in ker je tudi gostejša od istega svinca, ki jo presegajo le druge kovine, kot sta Osmium in Iridium. To je tudi najtežja kovina, za katero je znano, da izpolnjuje biološko vlogo v telesu.
V večini svojih ionskih spojin sodeluje volfstate anion, wo42-, ki lahko polimerizira, da povzroči grozde v kislem mediju. Po drugi strani lahko volfram tvori intermetalne spojine ali sterizira s kovinami ali anorganskimi soli, tako da njihove trdne snovi pridobijo različne oblike ali konsistence.
V Zemljini skorji ni zelo obilen, saj ima kot tona le 1,5 grama te kovine. Poleg tega je, ker je močan element, njen izvor intergalaktičen; Zlasti eksplozije Supernove, ki so morale med tvorbo metati "curke" volframovih atomov na naš planet.
[TOC]
Zgodovina
Etimologija
Zgodovina volframa ali Wolframio ima dva obraza, pa tudi njihova imena: eno Švicarsko in drugo Nemko. V 1600 -ih, v regijah, ki sta jih trenutno zasedala Nemčija in Avstrija.
Do takrat so rudarji v postopku srečali trn: obstajal je izjemno težaven mineral; Mineral je bil sestavljen iz wolframita, (vera, mn, mg)4, ki je ohranil ali "požrl" kositer, kot da bi bil volk.
Od tod etimologija tega elementa, volka Wolfa v španščini, volk, ki je jedel kositer; in 'RAM' iz pene ali smetane, katerih kristali so spominjali na dolgo črno krzno. Tako, da se je v čast teh prvih opažanj pojavilo ime "Wolfram" ali "Wolframio".
Leta 1758, na švicarski strani do podobnega minerala, Scheelita, Cawo4, Imenovan je bil "Tung Sten", kar pomeni "trdi kamen".
Obe imeni, Wolframio in Volfram, se pogosto uporabljata zamenljivo, odvisno samo od kulture. Na primer v Španiji in na evropskem zahodu to kovino bolj pozna Wolframio; medtem ko na ameriški celini prevladuje ime volframa.
Prepoznavanje in odkritje
Takrat je bilo znano, da sta med sedemnajstim in osemnajstim stoletjem obstajala dva minerala: Wolframit in Scheelita. Toda kdo je pogledal, da obstaja drugačna kovina od drugih? Lahko bi jih označili le za minerale, leta 1779.
Lahko vam služi: perbromska kislina (Hbro4): Lastnosti, tveganja in uporabeNa švicarski strani je Carl Wilhelm Scheele leta 1781 uspel izolirati volfram kot WO3; In še več, dobil je tumatsko (ali volframično) kislino, h2Wo4 in druge spojine.
Vendar to ni bilo dovolj, da bi dosegli čisto kovino, ker je bilo treba zmanjšati to kislino; to pomeni, da ga upošteva takšen postopek, ki ne bo mogel kisik in kristaliziranje kot kovina. Carl Wilhelm Scheele ni imel ustrezne metodologije za to reakcijo zmanjšanja kemikalije.
Tu so španski bratje D'Aluyar, Fausto in Juan José, ki so v mestu Bergara v mestu Bergara v mestu Bergara zmanjšali oba minerala (Wolframite in Scheelita). Dve sta dodeljena zasluga in čast, da sta bila odkrivalci Wolframium ali kovinskega volframa (W).
Jekla in žarnice
 Vsaka žarnica z volframovim nitjem. Vir: pxhere.
Vsaka žarnica z volframovim nitjem. Vir: pxhere. Tako kot druge kovine tudi njena uporaba določa svojo zgodovino. Med najpomembnejšimi do konca 19. stoletja so bile zlitine jeklene tungsten in volframove filamente za nadomeščanje ogljika znotraj električnih žarnic. Lahko rečemo, da so bile prve žarnice, kot jih poznamo, tržili v letih 1903-1904.
Lastnosti
Fizični videz
Je srebrna in siva kovina. Krhka, a velike trdote (ne zmede s trdoživostjo). Če je kos visoke čistosti, postane pokončen in trden, tako ali več in več jekel.
Atomska številka
74.
Molarna masa
183,85 g/mol.
Tališče
3422 ° C.
Vrelišče
5930 ° C.
Gostota
19,3 g/ml.
Fuzijska toplota
52,31 kJ/mol.
Toplota za uparjanje
774 kJ/mol.
Molarna toplotna sposobnost
24,27 kJ/mol.
Moh trdota
7.5.
Elektronegativnost
2,36 na lestvici Pauling.
Atomski radio
139 popoldne
Električna upornost
52.8 nΩ · m pri 20 ° C.
Izotopi
V naravi predstavlja pretežno kot pet izotopov: 182W, 183W, 184W, 186W in 180W. Glede na molarno maso 183 g/mol, ki povprečno atomske mase teh izotopov (in ostalih trideset radioizotopov) ima vsak atom volframa ali Wolframium približno sto in deset nevtronov (74 + 110 = 184).
Kemija
Je zelo odporen proti korozijski kovini, saj je tanka plast wo3 ščiti pred napadom kisika, kisline in alkalij. Ko se raztopijo in oborijo z drugimi reagenti, dobimo njihove soli, ki se imenujejo volframati ali volfrate; V njih ima volfram oksidacijsko stanje +6 (ob predpostavki, da obstajajo kationi6+).
Kislinsko grozdje
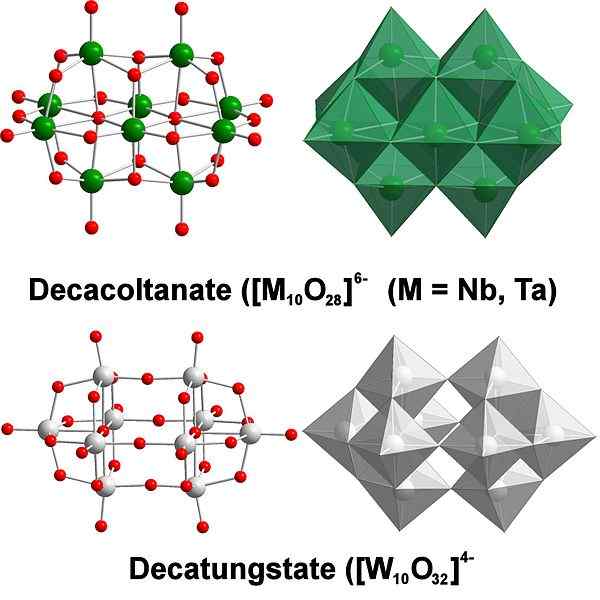 DecatungState, primer volframovega poliaksometalata. Vir: scifanz [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
DecatungState, primer volframovega poliaksometalata. Vir: scifanz [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Kemično je volfram precej poseben, ker so njegovi ioni ponavadi razvrščeni (v angleščini), da tvorijo heteropolycide ali poliaksometalat. Kaj so oni? So skupine ali grozdi atomov, ki se vežejo, da definirajo tridimenzionalno telo; predvsem ena s sferično kletko, v kateri "zapirajo" še en atom.
Vse se začne iz volfstate aniona, wo42-, Ki je v kislem mediju protoniran (hwo4-) in povezan s sosednjim anionom, da se oblikuje [W2Tudi7(OH)2]2-; In to se pridruži še enemu [W2Tudi7(OH)2]2- Izviriti [W4Tudi12(OH)4]4-. Torej, dokler v raztopini ni več politungstatov.
Vam lahko služi: litijev klorid (licl): lastnosti, tveganja in uporabeParathungState A in B, [W7Tudi24. 24]6- in h2W12Tudi4210-, oziroma so ena najbolj izjemnih od teh poliad.
Lahko postane izziv razmisliti o svojih skici in Lewisovih strukturah; Vendar je načeloma dovolj, da jih vizualiziramo kot wo oktahedra6 (Zgornja slika).
Upoštevajte, da ti sivkasti oktaedri na koncu definirajo DecatungState, Politgungstate; Če se heteroátomo zaklene v notranjost (na primer fosfor), bi bil to poliaksometalat.
Elektronska struktura in konfiguracija
Kristalne faze
Volframovi atomi definirajo kubično strukturo, osredotočeno na telo (BCC, do Kubični, osredotočeni na telo). Ta kristalna oblika je znana kot faza α; Medtem ko je β faza tudi kubična, a nekoliko gosta. Tako faze ali kristalne oblike, α in β, lahko sobivata v ravnovesju v normalnih pogojih.
Kristalna zrna α faze so izometrična, medtem ko so v β fazi spominjajo na stolpce. Ne glede na to, kako je kozarec v tej vladi. V nasprotnem primeru ni bilo mogoče razložiti visokih topov in vrelišč ali visoke trdote in gostote volframa.
Kovinska povezava
Atomi volframa so nekako zelo združeni. Za dvig domneve je treba pred tem opaziti elektronsko konfiguracijo te kovine:
[Xe] 4f145 d46s2
5D orbitale so zelo velike in zamegljene, kar bi pomenilo, da med dvema tesnima atomama obstajajo učinkovite orbitalne prekrivanja. Tudi orbitale 6s prispevajo k dobljenim pasom, vendar v manjši meri. Medtem ko imajo 4F orbitale "zelo globoko" in je njihov prispevek k kovinski povezavi nižji.
Ta, velikost atomov in kristalna zrna, so spremenljivke, ki določajo trdoto volframa in njeno gostoto.
Stanja oksidacije
V volframu ali kovinskem volframiju imajo atomi brez oksidacije (W0). Vrnitev na elektronsko konfiguracijo lahko 5D in 6S orbitale "izpraznijo" elektrone, odvisno od tega, ali je W v družbi zelo elektronegativnih atomov, kot sta kisik ali fluor.
Ko se izgubita dva 6S elektrona, ima volfram stanje oksidacije +2 (W2+), Kaj ustvarja, da se njen atom krši.
Če izgubite tudi vse elektrone svojih 5D orbital, bo vaš status oksidacije postal +6 (w6+); Od tu ne more postati bolj pozitiven (teoretično), saj bi 4F orbitale za notranje potrebne velike energije, da bi odstranili svoje elektrone. To pomeni, da je najbolj pozitivno oksidacijsko stanje +6, kjer ima volfram še majhno.
Ta volfram (VI) je zelo stabilen v kislih ali v mnogih kisikovih ali halogeniranih spojinah. Druga pozitivna in možna oksidacijska stanja so: +1, +2, +3, +4, +5 in +6.
Volfram lahko pridobi tudi elektrone, če je v kombinaciji z manj elektronegativnimi atomi kot on. V tem primeru njihovi atomi postanejo večji. Lahko pridobi največ štiri elektrone; to pomeni, da ima oksidacijsko stanje -4 (w4-).
Pridobivanje
Prej je bilo omenjeno, da je volfram v Wolframite in Scheelita Minerals. Glede na postopek sta od njih dobili dve spojini: volframovi oksid, wo3, ali amonium paratungstate, (NH4)10(H2W12Tudi42) · 4H2O (ali ATP). Vsak od njih se lahko zmanjša na kovinsko W s premog nad 1050 ° C.
Lahko vam služi: Raault zakon: načelo in formula, primeri, vajeNi ekonomsko donosen. Zato ga je najraje proizvajati v obliki prahu, da bi se enkrat ukvarjali z drugimi kovinami, da bi pridobili zlitine.
Omeniti velja, da je kitajski svet država z največjo proizvodnjo volframa. Na ameriški celini, Kanadi, Boliviji in Braziliji pa zasedajo tudi seznam največjih proizvajalcev te kovine.
Prijave
 Spojina za volframovo karbid: primer, kako lahko trdota te kovine uporabimo za ovekovečevanje in otrditev materialov. Vir: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Spojina za volframovo karbid: primer, kako lahko trdota te kovine uporabimo za ovekovečevanje in otrditev materialov. Vir: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Spodaj so omenjene nekatere znane uporabe te kovine:
-Njegove soli so bile uporabljene za barvanje bombaža starih gledališč.
-V kombinaciji z jeklo se še bolj strdi, tudi da se lahko upira mehanskim rezom pri visoki hitrosti.
-Volframove sintranske filamente se uporabljajo že več kot sto let v električnih žarnicah in halogeniranih svetilkah. Tudi zaradi visoke talilne točke je služil kot material za katodne cevi in za raketne motorje.
-Nadomešča svinca pri izdelavi izstrelkov in radioaktivnih ščitov.
-Volframove nanosake se lahko uporabijo v pH -občutljivem nanodispozitivnem.
-Volframovi katalizatorji so bili uporabljeni za obravnavo proizvodnje žvepla v naftni industriji.
-Tungsten Carbide je iz vseh njegovih spojin, ki pokriva več uporabe. Od krepitve orodij za rezo in vrtanje ali izdelavo vojaških kosov oborožitve do mehanizacije lesa, plastike in keramike.
Tveganja in previdnostni ukrepi
Biološko
Ker je razmeroma redka kovina v zemeljski skorji, so njeni negativni učinki redki. V kislih tleh politungstati morda ne vplivajo na encime, ki jih uporabljajo molibdati; Toda v osnovnih tleh, wo42- V presnovnih procesih moo se vmeša (pozitivno ali negativno)42- in baker.
Rastline lahko na primer absorbirajo topne spojine volframa in jih pojedo žival in nato po zaužitju mesa W atomi vstopijo v naše organizme. Večina je izgnanih v urin in iztrebki, in malo je znanega, kaj se zgodi z ostalimi.
Študije na živalih so pokazale, da ko visoke koncentracije volframovega praška razvijejo simptome, podobne pljučnemu raku.
Z zaužitjem bi moral odrasli človek piti na tisoče litrov vode, obogatene z volframovimi soli.
Fizično
Na splošno je volfram malo strupenega elementa, zato je malo tveganj za gostiteljsko škodo na zdravstveni škodi.
Glede kovinskega volframa bi se morali izogibati dihanju njegovega prahu; In če je vzorec trden, je treba upoštevati, da je zelo gost in da lahko povzroči telesno škodo, če pade ali zadene druge površine.
Reference
- Bell Terence. (s.F.). Volfram (Wolfram): lastnosti, proizvodnja, aplikacije in zlitine. Ravnovesje. Okreval od: uravnoteženosti.com
- Wikipedija. (2019). Volfram. Pridobljeno iz: v.Wikipedija.org
- Lentech b.V. (2019). Volfram. Okrevano od: Lentech.com
- Jeff Desjardins. (1. maj 2017). Zgodovina volframa, najmočnejša naravna kovina na zemlji. Okrevano od: VisualCapitalist.com
- Doug Stewart. (2019). Dejstva o volframovih elementih. Okrevano od: Chemicool.com
- Art Fisher in Pam Powell. (s.F.). Volfram. Univerza v Nevadi. Okrevano od: UNCE.a r.Edu
- Čelada, Anne Marie, ph.D. (2. marec 2019). Dejstva volframa ali Wolframa. Okreval od: Thoughtco.com

