Značilnosti treonina, funkcije, degradacija, koristi
- 4368
- 995
- Don Nitzsche
The Trenina (Thr, T) ali Treo-α-amino-β-butirična kislina je ena izmed sestavnih aminokislin celičnih beljakovin. Ker človeške in druge živali z vretenčarji nimajo biosintetskih poti za svojo proizvodnjo, se Treonin šteje.
Treonin je bil zadnji od 20 običajnih aminokislin, odkritih v beljakovinah, dejstvo, ki se je v zgodovini dogajalo več kot stoletje po odkritju asparagina (1806), ki je bila prva opisana aminokislina.
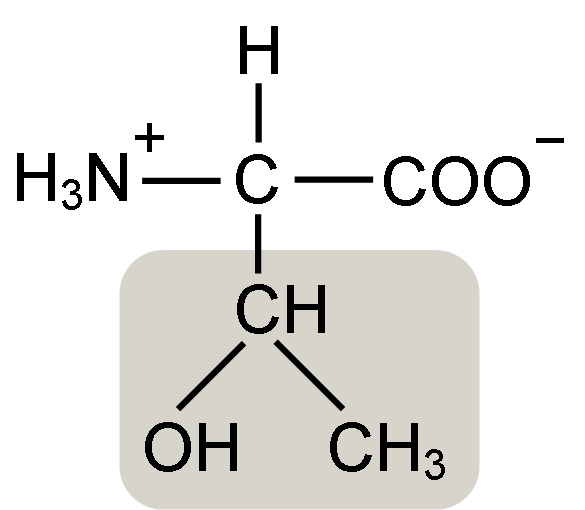
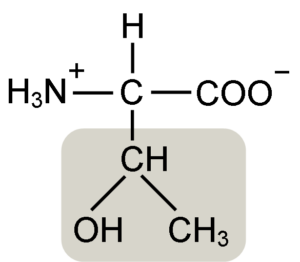 Struktura aminokislin Treonin (vir: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Struktura aminokislin Treonin (vir: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Odkril jo je William Cumming Rose leta 1936, ki je skoval izraz "treonin" za strukturno podobnost, ki jo je našel med to aminokislino in haraonsko kislino, spojino, pridobljeno iz treznega sladkorja.
Kot aminokislinski protein ima Treonin v celicah več funkcij, med katerimi je vezavno mesto za verige ogljikovih hidratov, značilno za glikoproteine in mesto prepoznavanja za beljakovinske kinaze s specifičnimi funkcijami (izstopajo Treoninske proteine/serinske kinaze)).
Podobno je Treonin bistvena sestavina beljakovin, kot so zobna sklenina, elastin in kolagen, in ima tudi pomembne funkcije v živčnem sistemu. Uporablja se kot prehrambeni dodatek in kot "blažilnik" fizioloških stanj tesnobe in depresije.
[TOC]
Značilnosti
Treonin pripada polarni aminokislinski skupini, ki ima skupino R ali stranske verige, ki nima pozitivnih ali negativnih obremenitev (ne obremenjene polarne aminokisline).
Značilnosti njegove skupine so narejene z zelo topno aminokislino (hidrofilno ali hidrofilno), kar velja tudi za ostale člane te skupine, kot so cistein, serin, asparagin in glutamin.
Skupaj s triptofanom, fenilalaninom, izolevcinom in tirozinom je treonin ena od petih aminokislin, ki ima tako glukogene kot ketogene funkcije, saj iz njegovega metabolizma obstajajo ustrezni posredniki, kot sta piruvat in succinil-CoA.
Ta aminokislina ima približno molekulsko maso 119 g/mol; Tako kot mnoge aminokisline brez obremenitve ima tudi izoelektrično točko okoli 5.87 in njegova frekvenca v beljakovinskih strukturah je blizu 6%.
Nekateri avtorji združujejo treonin skupaj z drugimi aminokislinami "sladkega" okusa, med katerimi so na primer serin, glicin in alanin.
Struktura
Α-aminokisline, kot je Treonin, imajo splošno strukturo, to je pogosta za vse. To odlikuje prisotnost ogljikovega atoma, znanega kot "α ogljik", ki je kiralno in do katerega so združene štiri vrste molekul ali različne substituente.
Ta ogljik deli eno od svojih vezi z vodikovim atomom, drugo s skupino R, ki je značilna za vsako aminokislino, druga dva Aminokisline.
Toninska skupina R ima hidroksilno skupino, ki mu omogoča, da v vodnih medijih tvori vodikove mostove z drugimi molekulami. Njeno identiteto lahko opredelimo kot alkoholna skupina (etanol z dvema atoma ogljika), ki je izgubila enega od njegovih vodikov, da se je pridružila ogljikove atoma α (-Chah-CH3).
Ta skupina -OH lahko služi kot "most" ali sindikalno mesto za različne molekule (to se lahko med nastajanjem glikoproteinov združi Spremenjeni derivati treonina.
Biološko aktivna oblika te aminokisline je L-treonin in prav ta sodeluje tako pri tvorbi beljakovinskih struktur kot v različnih presnovnih procesih, kjer deluje.
Funkcije
Kot aminokislinski protein je treonin del strukture številnih beljakovin v naravi, kjer je njen pomen in bogastvo odvisna od identitete in funkcije beljakovin, ki ji pripada.
Vam lahko služi: heteroza: izboljšanje pri živalih, v rastlinah, človekuTreonin poleg svojih strukturnih funkcij pri tvorbi peptidnega zaporedja beljakovin izpolnjuje druge funkcije tako v živčnem sistemu kot v jetrih, kjer sodeluje pri presnovi maščob in preprečuje kopičenje v tem organu v tem organu.
Treonin je del sekvenc, ki jih prepoznajo encimi kinaze Serín/Treonina, ki so odgovorni za številne procese fosforilacije beljakovin, ki so bistveni za uravnavanje množice funkcij in znotrajceličnih signalnih dogodkov.
Uporablja se tudi za zdravljenje nekaterih črevesnih in prebavnih motenj ter njegovo uporabnost pri slabljenju patoloških stanj, kot sta tesnoba in depresija.
L-treonin je tudi ena od aminokislin, potrebnih za vzdrževanje pluripotentnega stanja mišičnih embrionalnih matičnih celic, dejstvo, ki je očitno povezano s presnovo S-adenozil-metionina in z metilacijskimi dogodki histonov, ki so neposredno, ki so neposredno vključen v izražanje genov.
V industriji
Skupna lastnost za številne aminokisline je njegova sposobnost reakcije z drugimi kemičnimi skupinami, kot so aldehidi ali ketoni za nastanek značilnih "okusov" mnogih spojin.
Med temi aminokislinami je Treonin, ki kot serin reagira s saharozo med TOS.
Treonin je prisoten v številnih zdravilih naravnega izvora in tudi v številnih formulacijah prehranskih dodatkov, ki so predpisani bolnikom z podhranjenostjo ali imajo v tej aminokislini slabo prehrano.
Druga najbolj razvpita funkcija L-treonina in to sčasoma raste, je aditivna pri pripravi koncentrirane hrane za prašiče in perutninsko proizvodno industrijo.
L-treonin se v teh panogah uporablja kot prehrambeni dodatek pri slabih formulacijah z vidika beljakovin, saj to zagotavlja gospodarske prednosti in lajša pomanjkanje beljakovin, ki jih te domače živali porabijo.
Glavna oblika proizvodnje te aminokisline je običajno z mikrobno fermentacijo in svetovnimi proizvodnimi podatki za kmetijske namene za leto 2009 je presegla 75 ton.
Biosinteza
Treonin je ena od devetih esencialnih aminokislin za človeka, kar pomeni, da ga telesne celice ne morejo sintetizirati in zato je treba pridobiti iz beljakovin živalskega ali rastlinskega izvora, ki so dobavljeni z vsakodnevno prehrano.
Rastline, glive in bakterije sintetizirajo treonin s podobnih poti, ki lahko med seboj predstavljajo nekaj odstopanj. Vendar se večina teh organizmov začne od Asparta kot predhodnika, ne le za treonin, ampak tudi za metodo in lizin.
Biosintetska pot v mikrobih
Biosintezna pot L-treonina v mikroorganizmih, kot so bakterije, je sestavljena iz petih korakov, ki jih katalizirajo različni encimi. Pod odhoda, kot je bilo komentirano, je aspartat, ki ga fosforilira z encim ATP-odvisni Quinasa Aspartat.
This reaction produces the Metabolite L-asphat phosphate (L-aspartil-p) that serves as a substrate for the semiiadehydic aspartyl enzyme dehydrogenase, which catalyzes its conversion into semi-the-dependent semi-the-dependent aspartyl.
Semiiardhaide aspartil se lahko uporablja tako za biosintezo L-lizina kot za biosintezo L-treonina; V tem primeru molekulo uporablja homoserinski encim, odvisno od odvisnosti od NADPH za proizvodnjo L-homoserina.
L-homoserin je fosforiliran na L-homoserinski fosfat (L-homoserina-P) s homoserinsko kinazo, odvisno od ATP, in omenjeni reakcijski produk.
L-metionin je mogoče sintetizirati iz L-homoserina, nastajanega v prejšnjem koraku, tako da predstavlja "tekmovalno" pot za sintezo L-treonina.
Sintetizirani L-treonin na ta način se lahko uporabi za sintezo beljakovin ali pa se lahko uporabi tudi za sintezo glicina in L-levcina, dve ustrezni aminokislini tudi z vidika proteina.
Vam lahko služi: evolucijske teorijeUredba
Pomembno je poudariti, da tri od petih encimov, ki sodelujejo v biosintezi L-treonina v bakterijah, uravnavajo produkt reakcije z negativnimi povratnimi informacijami. To so kinazni aspartat, homoserinska dehidrogenaza in homoserinska kinaza.
Poleg tega je regulacija te biosintetske poti odvisna tudi od celičnih potreb drugih biosintetskih produktov, povezanih z njo, saj je tvorba L-lizina, L-metionina, L-izolevcina in glicina odvisna od proizvodnje proizvodnje proizvodnje proizvodnje L-Treonin.
Degradacija
Treonin lahko razgradimo z dvema različnima potma, da nastane piruvat ali sukcinil-CoA. Slednje je najpomembnejši produkt katabolizma treonina pri ljudeh.
Metabolizem treonina se pojavlja predvsem v jetrih, toda trebušna slinavka, čeprav v manjši meri, sodeluje tudi v tem procesu. Ta pot se začne s prevozom aminokisline skozi plazemsko membrano hepatocitov s pomočjo specifičnih prevoznikov.
Proizvodnja piruvata iz treonina
Pretvorba treonina v piruvat se pojavi zahvaljujoč preobrazbi v glicin, ki poteka v dveh katalitičnih korakih, ki se začnejo s tvorbo 2-amino-3-ekotobutirata iz Treonina in z delovanjem encima Treonin dehidrogenaze.
V človeku ta pot predstavlja le med 10 in 30% katabolizma treonina, vendar je njen pomen povezan z organizmom, ki se na primer šteje za druge sesalce.
Proizvodnja Succinil-CoA iz Treonina
Tako kot pri Metioninu, Valini in izoleucinu se tudi za proizvodnjo sukunil-CoA uporabljajo tudi ogljikovi atomi treonina. Ta postopek se začne s pretvorbo aminokisline v α-cetobutirat, ki se pozneje uporablja kot substrat encima α-Zo-S stoat dehidrogenaze za izvajanje propionil-CoA.
Transformacija treonina v α-ce-cekutirat katalizira encim dehidrataza, kar pomeni izgubo molekule vode (H2O) in drugega amonijevega iona (NH4+).
Propionil-CoA je karboksiliran v metilmalonil-CoA z dvostopenjsko reakcijo, ki zahteva vnos bikarbonatnega ogljikovega atoma (HCO3-). Ta izdelek služi kot substrat za metilmalonil-CoA mutasa-koencim B12, ki "epimerizira" molekulo za proizvodnjo sukcinil-CoA.
Drugi katabolični izdelki
Poleg tega se lahko ogljikov okostje treonina katabolično uporablja za proizvodnjo acetil-CoA, ki ima tudi pomembne posledice z energijskega vidika v telesnih celicah.
V nekaterih organizmih Treonin deluje tudi kot substrat nekaterih biosintetskih poti, kot je izolevcin. V tem primeru lahko skozi 5 katalitičnih korakov α-ektobutirat, ki izhaja iz katabolizma treonina.
Živila, bogata s treninom
Čeprav ima večina obilne hrane v beljakovinah določen odstotek vseh aminokislin, je bilo ugotovljeno, da so jajca, mleko, soja in želatina še posebej bogata z aminokislino Treonina.
Treonin je tudi v živalskem mesu, kot so piščanec, prašič, zajček, jagnjetina in različne vrste ptic. V hrani rastlinskega izvora je obilno v holeh, na čebuli, česnu, šardu in jajčevcih.
Najdemo ga tudi v rižu, koruzi, pšenici, zrnih stročnic in v številnih sadju, kot so jagode, banane, grozdje, ananas, slive in drugi oreščki, ki so bogati z beljakovinami, kot so oreščki ali pistacije,, med drugim.
Prednosti vašega vnosa
Po mnenju Odbora strokovnjakov Svetovne zdravstvene organizacije za kmetijstvo in hrano (WHO, FAO) je Treonina dnevna zahteva za povprečnega odraslega človeka približno 7 mg na kilogram telesne teže, ki jo je treba pridobiti iz hrane, ki jo zaužijemo s prehrano.
Vam lahko služi: rdeča fenola: značilnosti, priprave, aplikacijeTe številke izhajajo iz eksperimentalnih podatkov, pridobljenih iz študij, opravljenih z moškimi in ženskami, kjer ta količina treonina zadostuje za dosego pozitivnega ravnovesja dušika v telesnih celicah.
Vendar so študije z otroki med 6 meseci in enim letom pokazale, da so za te minimalne zahteve L-treonina med 50 in 60 mg na kilogram teže na dan.
Med glavnimi prednosti vnosa prehranskih dodatkov ali zdravil s posebnimi formulacijami, bogato z L-treoninom.
Dodatna oskrba s treoninom daje prednost absorpciji hranil v črevesju in tudi prispeva k izboljšanju jetrnih funkcij. Pomembno je tudi za transport fosfatnih skupin skozi celice.
Motnje pomanjkanja
Pri majhnih otrocih so rojene okvare v presnovi treonina, ki povzročajo zamudo rasti in druge povezane presnovne motnje.
Pomanjkljivosti v tej aminokislini so bile povezane z nekaterimi napakami pri povečanju telesne mase, poleg drugih patologij, povezanih s pomanjkanjem zadrževanja dušika in izgubo urina.
Človeška bitja, ki so v Treonini podvrženi slabi prehrani, imajo lahko večjo nagnjenost k trpljenju maščobnih jeter in nekaterih črevesnih okužb, povezanih s to aminokislino.
Reference
- Barret, g., & Elmore, D. (2004). Aminokisline in peptidi. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Young, V. R. (2002). Treonin zahteva zdravih odraslih, ki je bila izvedena s 24-urno indikatorsko tehniko amininokislin. American Journal of Clinical Nutrition, 75(4), 698–704.
- Bradford, h. (1931). Zgodovina odkritja aminokislin. Ii. Pregled aminokislin, opisanih od leta 1931, kot sestavine izvornih beljakovin. Napredek v kemiji beljakovin, 81-171.
- Champe, str., & Harvey, r. (2003). Aminokisline aminokisline. V Ilustrirane ocene Lippincotta: Biokemija (3. izd., pp. 1-12). Lippincott.
- De Lange, c. F. M., Gillis, a. M., & Simpson, g. J. (2001). Vpliv vnosa treonina na odlaganje beljakovin Whoe-telesa in uporabo treonina pri gojenju prašičev, ki jih hranijo prečiščene diete. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs in. (1987). Serin/treonin kinazni protein. Annu. Rev., 56, 567-613.
- Edsall, J. (1960). Amininokisline, beljakovine in biokemija raka (Vol. 241). London: Academic Press, Inc.
- Hiša, j. D., Hall, b. N., & Brosnan, J. T. (2001). Presnova treonina v izoliranih hepatocitih podgane. American Journal of Physiology - Endokrinologija in metabolizem, 281, 1300-1307.
- Hudson, b. (1992). Biokemija prehranskih beljakovin. Springer-Science+Business Media, B.V.
- Kaplan, m., & Flavin, m. (1965). Treonin biosinteza. Na poti v glivah in bakterijah ter mehanizmu izomerizacijske reakcije. Časopis za biološko kemijo, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (devetnajst devetdeset šest). L-Threonin za perutnino: pregled. Applied Peruetry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, str., & Holt in. (1954). Treonin zahteva običajnega dojenčka. Časopis za prehrano, 10(56), 231-251.
- Rigo, j., & Senterre, J. (1980). Optimalni vnos treonina za prezgodnjo oznako, ki se hrani na oralni ali parenteralni prehrani. Časopis za parenteralno in enteralno prehrano, 4(1), 15-17.
- Shyh-Chang, n., Locasale, j. W., Lyssiotis, c. Do., Zheng in., Teo, r. In., Ratanasirintrawoot, s.,... Cantley, L. C. (2013). Vpliv metabolizma treonina na metilacijo S-adenezilmetionina in histona. Znanost, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. Do. (1931). Zgodovina odkritja aminokislin. Kemični pregledi, 9(2), 169–318.
- MD splet. (n.d.). Pridobljeno 10. septembra 2019 z www.Webmd.com/vitamini/ai/sestavinmono-1083/treonin
- Wormser, e. H., & Pardee, do. B. (1958). Regulacija biosinteze treonina v Escherichia coli. Arhiv biokemije in biofizike, 78(2), 416–432.
- Xunyan, x., Quinn, str., & Xiaoyuan, x. (2012). Raziskovalna vrata. Pridobljeno 10. septembra 2019 z www.ResearchGate.NET/SLIKA/THE-BIOSYNTHESA-PATHWAY-OF-L-THREONINA-THE-PATHWAY-CONSISTS-OF-FI-VE-ENZIMMMATIC-STEPS_FIG1_232320671

