Kaj je, molekularni diagram energije in vadba
- 1574
- 212
- Roman Schamberger
The prepustnost Optika je količnik med nastajajočo intenzivnostjo svetlobe in intenzivnost svetlobe na vzorcu prosojne raztopine, ki je bila osvetljena z enobarvno svetlobo.
Fizični proces prehoda svetlobe skozi vzorec se imenuje Svetlobni menjalnik in prepustnost To je merilo prenosa svetlobe. Prepustnost je pomembna vrednost za določitev koncentracije vzorca, ki se običajno raztopi v topilu, kot sta voda ali alkohol.
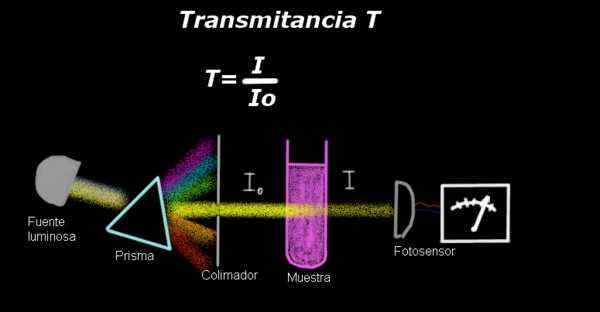
 Slika 1. Montaža za merjenje prepustnosti. Vir: f. Zapata.
Slika 1. Montaža za merjenje prepustnosti. Vir: f. Zapata. Elektro-fotometer meri trenutni sorazmerni z intenzivnostjo svetlobe, ki vpliva na njegovo površino. Za izračun prepustnosti se na splošno meri signal intenzivnosti, ki ustreza samo topilu in ta rezultat se zabeleži kot Io.
Nato je vzorec, raztopljen v topilu z enakimi svetlobnimi pogoji in izmerjeni signal z elektro-fotometrom, označen, kot je označen kot kot Yo, Nato se prepustnost izračuna po naslednji formuli:
T = i / itudi
Treba je opozoriti, da je prepustnost brezdimenzionalna količina, saj je merilo intenzivnosti svetlobe v primerjavi z intenzivnostjo prenosa topila.
[TOC]
Kaj je prepustnost?
Absorpcija svetlobe v mediju
Ko svetloba prehaja skozi vzorec, del svetlobe absorbira molekule. Prepustnost je makroskopska mera pojava, ki se pojavi na molekularni ali atomski ravni.
Svetloba je elektromagnetni val, energija, ki jo prevaža, je v električnem in magnetnem polju vala. Ta nihajna polja delujejo z molekulami snovi.
Lahko vam služi: Rutherford Atomski model: Zgodovina, poskusi, postulatiEnergija, ki prevaža val, je odvisna od njegove frekvence. Enobarvna svetloba ima le eno frekvenco, medtem ko ima bela svetloba frekvenčno območje ali spekter.
Vse frekvence elektromagnetnega vala potujejo v vakuumu z isto hitrostjo 300000 km/s. Če označujemo c S hitrostjo svetlobe v vakuumu je razmerje med frekvenco F in valovna dolžina λ je:
C = λ⋅f
Kot c Je konstanta pri vsaki frekvenci ustreza njegovi valovni dolžini.
Za merjenje prepustnosti snovi se uporabljajo območja vidnega elektromagnetnega spektra (380 nm pri 780 nm), ultravijolično območje (180 do 380 nm) in infrardeče (780 nm do 5600 nm)
Hitrost širjenja svetlobe v materialnem mediju je odvisna od frekvence in je manjša od c. To pojasnjuje disperzijo v prizmi, s katero lahko ločimo frekvence, ki sestavljajo belo svetlobo.
Molekularna teorija absorpcije svetlobe
Atomi in molekule imajo kvantizirano raven energije. Pri sobni temperaturi so molekule na najnižji ravni energije.
Foton je kvantni delček, povezan z elektromagnetnim valom. FOTON Energy je tudi kvantiziran, torej frekvenčni foton F Ima energijo, ki jo daje:
E = H⋅f
kje h To je Planckova konstanta, katere vrednost je 6,62 × 10^-34 j⋅s.
Enobarvna svetloba je žarek fotonov frekvence in dane energije.
Molekule absorbirajo fotone, kadar njihova energija sovpada z razliko, potrebno za prenos molekule na višjo raven energije.
Prehodi energije z absorpcijo fotonov v molekulah so lahko več vrst:
Vam lahko postreže: motor s kletkami veverice1- Elektronski prehodi, ko elektroni molekulskih orbitalov prehajajo v orbitalo večje energije. Ti prehodi se običajno pojavljajo v vidnem in ultravijoličnem območju in so najpomembnejši.
2- vibracijski prehodi, molekulske energije vezi so tudi kvantizirane in ko se foton infrardeče regije absorbira, molekula prehaja v višje vibracijsko energijsko stanje.
3-rotacijski prehodi, ko absorpcija fotona vodi v molekulo v rotacijsko stanje večje energije.
Molekularni diagram energije
Ti prehodi je bolje razumeti z molekulskim diagramom energije, prikazanim na sliki 2:
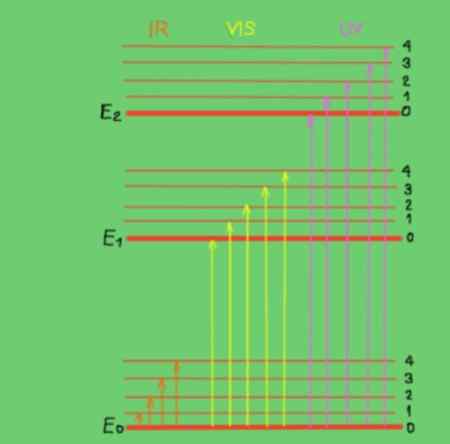 Slika 2. Molekularni diagram energije. Vir: f. Zapata.
Slika 2. Molekularni diagram energije. Vir: f. Zapata. V diagramu vodoravne črte predstavljajo različne ravni molekulske energije. Linija E0 je temeljna ali nižja raven energije. Ravni E1 in E2 sta vzbujeni ravni večje energije. Ravni E0, E1, E2 ustrezajo elektronskim stanjem molekule.
Pod -ravni 1, 2, 3, 4 znotraj vsake elektronske ravni ustrezajo različnim vibracijskim stanjem, ki ustrezajo vsaki elektronski ravni. Vsaka od teh ravni ima najboljše pododdelke, ki niso prikazani, ki ustrezajo rotacijskim stanjem, povezanim z vsako vibracijsko raven.
Diagram prikazuje navpične puščice, ki predstavljajo energijo fotonov v infrardečem, vidnem in ultravijoličnem območju. Kot je razvidno, infrardeči fotoni nimajo dovolj energije za spodbujanje elektronskih prehodov, namesto vidnega sevanja in ultravijoličnega.
Ko vpadni fotoni enobarvnega žarka sovpadajo z energijo (ali frekvenco) z razliko v energiji med stanji molekulske energije, potem pride do absorpcije fotonov.
Vam lahko služi: termometrične lestviceDejavniki, odvisno od prepustnosti
Glede na to, kar je bilo rečeno v prejšnjem razdelku, bo nato prepustnost odvisna od več dejavnikov, med katerimi lahko poimenujemo:
1- frekvenca, s katero se vzorec prižge.
2- Vrsta molekul, ki jih želite analizirati.
3- koncentracija raztopine.
4- Dolžina poti je potovala skozi svetlobni žarek.
Eksperimentalni podatki kažejo, da je prepustnost T se eksponentno zmanjšuje s koncentracijo C in z dolžino L optične poti:
T = 10-A⋅c⋅l
V prejšnjem izrazu do To je konstanta, ki je odvisna od frekvence in vrste snovi.
Vaja rešena
Vaja 1
Vzorec vzorca določene snovi ima koncentracijo 150 mikromolov na liter (μm). Ko izmerite vašo prepustnost s 525 nm, dobimo prepustnost 0 0.4.
Še en vzorec iste snovi, vendar ima neznana koncentracija 0 prepustnost.5, kadar merimo na isti frekvenci in z enako optično debelino.
Izračunajte koncentracijo drugega vzorca.
Odgovor
Prepustnost t razpada eksponentno s koncentracijo C:
T = 10-B⋅l
Če vzamete logaritem prejšnje enakosti, ostaja:
dnevnik t = -b⋅c
Delitev člana na člana Prejšnja enakost, ki se uporablja za vsak vzorec, in čiščenje neznane koncentracije ostaja:
C2 = c1⋅ (log t2 / log t1)
C2 = 150 μm⋅ (log 0.5 / dnevnik 0.4) = 150 μm⋅ (-0.3010 / -0.3979) = 113.5 μm
Reference
- Atkins, str. 1999. Fizikalna kemija. Omega izdaje. 460-462.
- Vodnik. Prepustnost in absorbanca. Okrevano od: Kemija.Laguia2000.com
- Okoljska toksikologija. Prepustnost, absorbanca in zakon Lamberta. Obnovi se od: skladišče.Inovacija.je
- Pustolovska fizika. Absorbanca in prepustnost. Okrevano od: rpfisica.Blogspot.com
- Sistofotometrija. Okrevano od: kem.Librettexts.org
- Okoljska toksikologija. Prepustnost, absorbanca in zakon Lamberta. Obnovi se od: skladišče.Inovacija.je
- Wikipedija. Prepustnost. Okreval od: Wikipedia.com
- Wikipedija. Spektrofotometrija. Okreval od: Wikipedia.com

