Transaminacija
- 3273
- 406
- Ricky Dach
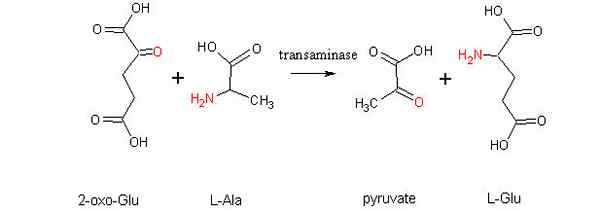
 Shema reakcije aminotransference med aminokislino in alfa-zoacidom (vir: alcibiade prek Wikimedia Commons)
Shema reakcije aminotransference med aminokislino in alfa-zoacidom (vir: alcibiade prek Wikimedia Commons) Kaj je transaminacija?
The transaminacija To je vrsta kemijske reakcije, ki deluje v "prerazporeditvi" aminokislinskih skupin, saj obdaja reverzibilne procese aminacije (dodajanje amino skupine) in srčne utripa (izločanje amino skupine), ki jih katalizirajo specifični encimi znane kot transaminaze ali aminotransferaze.
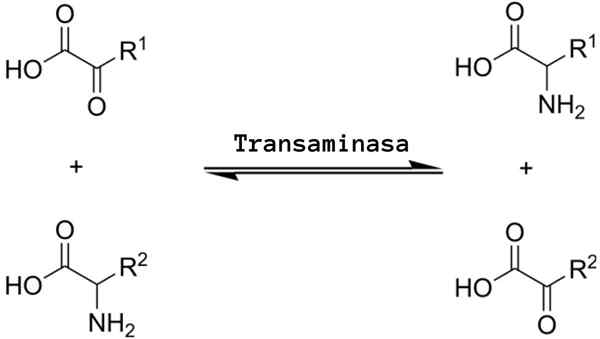
Splošna reakcija na transaminacijo pomeni izmenjavo med aminokislino in katerim koli α-Zo-Sfiltom, kjer izmenjava amino skupine daje ketocidno različico prve aminokisline in aminokislinske različice prvega α-zo-ekotocidnega substrata.
Amino skupina, ki se običajno izmenjuje, je amino "alfa", to je tista, ki sodeluje pri tvorbi peptidnih povezav in opredeljuje strukturo aminokislin, čeprav reakcije, ki vključujejo druge amino skupine v različnih položajih v različnih položajih v v različnih položajih lahko pride do različnih položajev v.
Z izjemo lizina, treonina, prolina in hidroksiprolina vse aminokisline sodelujejo pri transaminacijskih reakcijah, čeprav so za histidin, serin, metoda in fenilalanin opisani transaminaze, vendar njihove presnovne poti ne pomenijo te vrste reakcij.
Transaminacijske reakcije med aminokislinami in α-cetoacidi sta leta 1937 odkrila Braunstein in Kritzmann, in od takrat so bili podvrženi intenzivnim študijam, saj se pojavljajo v številnih tkaninah različnih organizmov in z različnimi nameni.
Pri ljudeh so na primer transaminaze široko razporejene v telesnih tkivih in so še posebej aktivne v srčnem mišičnem tkivu, v jetrih, v skeletnem mišičnem tkivu in v ledvicah.
Reakcijski mehanizem
Transaminacijske reakcije pomenijo bolj ali manj isti mehanizem. Kot že omenjeno, se te reakcije pojavljajo kot reverzibilna izmenjava amino skupine med aminokislino in α-Zo-CID.
Vam lahko služi: keramični materiali: značilnosti, vrste, primeriTe reakcije so odvisne od spojine, znane kot fosfat piridoksal, derivata vitamina B6, ki sodeluje kot amino skupinski transporter in se veže na transaminazne encime s tvorbo schiffove baze med aldehidno skupino te molekule in ε-amino A ostanki lizina na aktivnem mestu encima.
Zveza med fosfatnim piridoksalom in ostankom lizina na aktivnem mestu ni kovalentna, ampak je dana z elektrostatično interakcijo med pozitivno obremenitvijo dušika v lizinu in negativno obremenitvijo v fosfatni skupini piridoksala.
Med reakcijo aminokislina, ki deluje kot substrat, izpodriva ε-amino skupino ostankov lizina na aktivnem mestu, ki sodeluje v bazi Schiffa s piridoksalom.
Medtem se par aminokislinskih alfa ogljikovih elektronov odstrani in prenese na piridinski obroč, ki sestavlja fosfat piridoksal (s pozitivnim nabojem) in nato "dostavljene" v α-Zo-ZID, ki deluje kot drugi substrat.
Na ta način piridoksalni fosfat ne sodeluje samo pri prenosu ali transportu aminokislin med aminokislinami in α-ekotocidi, ki so substrat transaminaz, ampak tudi deluje kot "umivalnik" elektronov, ki olajša disociacijo vodik alfa kisline.
Če povzamemo, prva substrat, aminokislina, svojo amino skupino prenaša na fosfat piridoksal, od koder se pozneje prenese na drugi substrat, α-Zo-ecotoide, ki se v vmesnem času tvori, vmesna spojina, znana kot piridoksamin fosfat.
Vam lahko služi: stolpčna kromatografijaFunkcija transaminacije
Encime transaminaze na splošno najdemo v citosolu in mitohondrijih in delujejo pri integraciji različnih presnovnih poti.
Glutamat dehidrogenaza v svoji obratni reakciji lahko na primer glutamat spremeni v amonija, NADH (ali NADPH) in α-ZETOGLUTARAT, ki lahko vstopi v cikel trikarboksilnih kislin in deluje v proizvodnji energije v proizvodnji energije.
Ta encim, ki je v mitohondrijski matrici, predstavlja točko veje, ki aminokisline povezuje z energijskim presnovnim namen.
Oblikovanje encima (glutamata dehidrogenaze) med razvojem možganov je bistvenega kar škoduje zdravju možganov.
V nekaterih jetrnih celicah se lahko transaminacijske reakcije uporabijo tudi za sintezo glukoneogeneze glukoze.
Glutamin se pretvori v glutamat in amonij z encimom glutaminaze. Nato se glutamat pretvori v α-Zetoglutarat, ki vstopi v Krebsovo cikel in nato v glukoneogenezo. Ta zadnji korak se zgodi zahvaljujoč Malo, enem od izdelkov na poti, se prevaža zunaj mitohondrijev s pomočjo shuttle.
Ta shuttle pušča α-cethoglutarat na milost encima Málica, zaradi česar je piruvat. Nato lahko pretvorimo dve molekuli piruvata, nato pa molekula glukoze skozi glukoneogenezo.
Vam lahko postreže: Flask Flat BackgroundPrimeri
Najpogostejše transaminacijske reakcije so povezane z alaninskimi aminokislinami, glutaminsko kislino in asparaginsko kislino.
Nekateri encimi aminotransferaze lahko poleg piridoksalnega fosfata piruvat uporabljajo kot "koencim", kot je to primer pri transaminaznem glutamatu-rivatu, ki katalizira naslednjo reakcijo:
glutamat + piruvat ↔ alanin + α-cetoglutarat
Mišične celice so odvisne od te reakcije, da nastanejo alanin iz piruvata in pridobivajo energijo skozi KREBS cikel s pomočjo α-Zetoglutarata. V teh celicah je uporaba alanina kot vira energije odvisna od izločanja amino skupin kot amonijevih ionov v jetrih, skozi cikel sečnine.
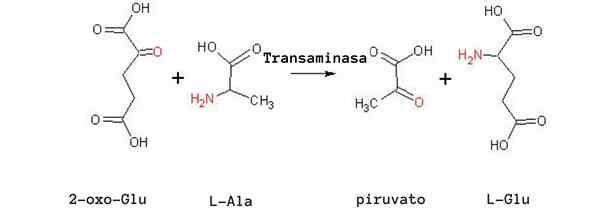 Alanin transaminacija reakcija (vir: Drab Tomas [javna domena] prek Wikimedia Commons)
Alanin transaminacija reakcija (vir: Drab Tomas [javna domena] prek Wikimedia Commons) Druga zelo pomembna reakcija transaminacije pri različnih vrstah je, da jo katalizira encim aspartat aminotransferaza:
L-špartato + α-ketoglutarat ↔ oksalacetat + l-glutamat
Nazadnje, nenazadnje, reakcija transaminacije γ-aminobutirne kisline (GABA), neproteinska aminokislina za centralni živčni sistem, ki deluje kot zaviralni nevrotransmiter. Reakcijo kataliziramo z γ-aminobutirično transaminazno kislino in je bolj ali manj na naslednji način:
α-ketoglutarat + 4-aminobutanojska kislina ↔ glutamat + sukcinični pol-avtomobil
Sukcinična pol -semina uporaba se pretvori v sukcinsko kislino z oksidacijsko reakcijo, slednja.

