Ogljikov atom
- 4101
- 122
- Percy Feeney
Pojasnjujemo, kaj je ogljikov atom, njena elektronska struktura, značilnosti in orbitalna hibridizacija.
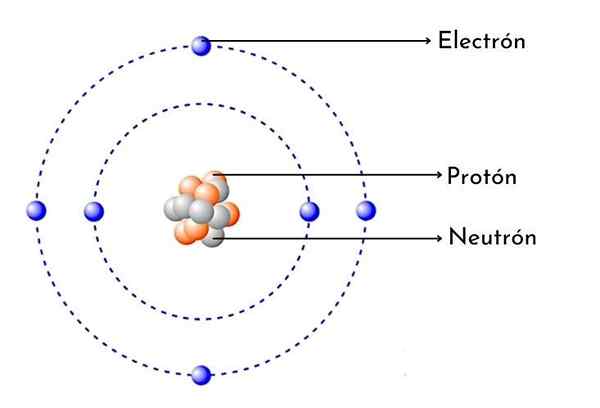
 Shema ogljikovega atoma
Shema ogljikovega atoma Kaj je ogljikov atom?
Carbon je številka 6 periodične tabele in je eden najpomembnejših elementov. Njegov pomen izhaja iz zelo bogate in raznolike kemije, zaradi katere ta element oblikuje Baza življenja na planetu Zemlja, Kot vemo.
Gre za nevični pripadnost Skupina 14 periodične tabele (prej skupina 4A) in drugo obdobje. V svoji naravni obliki je povezan s premog (mineralno in zelenjavo) in saje, v kateri je predvsem v obliki grafita ali drugega alotropa.
On Ogljikov atom Je med najmanjšo periodično tabelo. To je tetravalentni atom, torej lahko tvori do štiri povezave z drugimi atomi, ki so enaki ali drugačni od istih.
Ogljik je zelo pomemben za ljudi. Je ena glavnih sestavin našega telesa, ki tvori več kot 19% njegove mase. Poleg tega ima tudi več tehnoloških aplikacij, ki izhajajo iz atomskih lastnosti.
Značilnosti ogljikovega atoma
- Atom ogljika je ne -kometal: Ogljik je nemetalni element, ki ga je mogoče kombinirati z mnogimi drugimi elementi periodične tabele. Ogljikovi atomi lahko pridobijo ali dajo elektrone drugim atomom, pri čemer postanejo anioni ali kationi.
- Ima 6 protonov v svojem jedru: Atomsko število ogljika je 6, kar pomeni, da ima v svojem jedru 6 protonov. Pomeni tudi, da ima nevtralni atom ogljika 6 elektronov okoli jedra.
Vam lahko služi: magnetna ločitev- Pripada bloku P periodične tabele: Elektronska konfiguracija ogljika v svojem temeljnem stanju je 1S2 2s2 2 p2. Kot je razvidno, so zadnji elektroni Valencije nameščeni v P orbitalih, zato ogljik pripada bloku P periodične tabele.
- Valence ogljikovega atoma so +2, +4 in -4: V ogljikovi valenčni plasti manjkajo le 4 elektrone, da se v celoti napolnijo in tako pridobijo elektronsko konfiguracijo plemenitega neonskega plina. Zaradi tega lahko ogljik tvori karbidni anion, c4-, ki ima 4 elektrone več kot nevtralni ogljik. Po drugi strani pa lahko ogljikov atom izgubi tudi dva 2P elektrona in tako postane ogljikov kation (c2+) ali ali vsi 4 elektroni v Valenciji, ki postanejo ogljikovi kation (c4+).
- Lahko oblikujete več alotropov: Elementarni ogljik najdemo v dveh skupnih naravnih oblikah, ki sta grafit in diamant, ki imajo korenito nasprotne lastnosti. Poleg tega lahko oblikujete različne fante, ogljik in grafenske nanocevke.
Trije izotopi ogljikovega atoma
Vsi atomi ogljika imajo v svojem jedru šest protonov, vendar vsi nimajo enakega števila nevtronov, kar povzroča tri izotope:
- Ogljik-12 (12C): Je najbolj stabilen in obilen (približno 98,9%). Ima 6 nevtronov v svojem jedru.
- Ogljik-13 (13C): Ima 7 nevtronov.
- Ogljik-14 (14C): To je radioaktivna YS E, ki jih uporablja za datume starih predmetov.
Elektronska struktura ogljikovega atoma
Kot vsak atom ogljika ima tudi v svojem jedru šest pozitivnih protonov, potem ima tudi on 6 elektronov z negativno obremenitvijo.
Vam lahko služi: alikvot (kemija)Način porazdelitve teh elektronov ali elektronska konfiguracija ogljikovega atoma je:
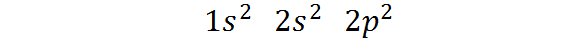
Ta elektronska konfiguracija kaže Carbon ima 2 elektrona v 1S orbitali, Dva elektrona v orbitali 2s, in Dva elektrona, razporejena med tremi orbitali 2p.
Po drugi strani je valenčna plast za ogljik plast L, ki ustreza ravni n = 2, saj je plast najvišje ravni, ki vsebuje elektrone. Kot vidimo, ima ogljik skupaj 4 elektroni na ravni 2, Torej to rečemo Ima 4 elektrone Valencije.
To je razlog, zakaj se nahaja ogljik, v katerem se je prej imenovala skupina 4A periodične tabele.
Atomska orbitalna hibridizacija v ogljikovem atomu
Atomi reagirajo in se med seboj povezujejo prek svojih valenčnih elektronov in orbitalov, ki jih zasedajo. Vendar slednji nimajo vedno ustrezne usmeritve, da bi tvorili potrebne povezave.
Teorija povezav Valencia navaja, da atomi mešajo svoje atomske orbitale, da tvorijo nove hibridne orbitale, ki imajo ustrezne napotke. Ta postopek se imenuje hibridizacija.
Glede na število atomov, na katere je povezan ogljikov atom. To povzroči tri različne hibridizacije, Kaj so oni:
Sp
Se pojavi, ko je ogljik povezan samo z Dva atoma. V tem primeru je orbitala s eno od treh P orbital mešana, kar povzroči dve SP orbitali, ki kažejo v nasprotne smeri (180 ° drug od drugega).
Vam lahko služi: Mercury BarometerDve p orbitali, ki ostaneta brez mešanja, se uporabljata za oblikovanje Pi vezi. Ogljikov atom se lahko tvori Trojna povezava (ki vsebuje dve PI vezi) z enim atomom ali lahko tvori Dve dvojni povezavi, po enega z vsakim atomom (in s povezavo pi).
Sp2
Ko se Carbon želi pridružiti Trije atomi, Potrebujete tri hibridne orbitale, zato zmešajte tri čiste orbitale: Orbital S in dve orbitali P. To ustvari tri hibridne orbitale SP2 to kaže na vogale enakostraničnega trikotnika.
Orbitalni p, ki ni bil uporabljen, lahko tvori pi povezavo s katerim koli od treh povezanih atomov, kar povzroči dvojno vezjo.
Sp3
Ko se bo ogljik povezal Štirje atomi, Zmešajte 4 čiste orbitale vaše valenčne plasti, da ustvarite 4 hibridne orbitalne sp3. To kažejo na točke navadnega tetraedrona.
Ker ni orbital, ki bi tvorili Pi vezi, ogljik s hibridizacijo SP3 Lahko oblikujete samo štiri preproste povezave in brez več povezav.
Reference
- Britannica, urednica Encyclopeedia. Ogljik - dejstva, uporabe in lastnosti. Vzeti iz https: // www.Britannica.com/znanost/ogljikovi-kemijski element
- Globalni laboratorij za spremljanje. (s. F.). Toplogredni plini iz ogljikovega cikla. Vzeti iz https: // gml.NOAA.Gov/ccg/izotopi/kemija.Html

