Toluenska struktura, lastnosti, uporabe, pridobivanje
- 1169
- 270
- Roman Schamberger
On Toluen To je aromatični ogljikovodik, katerega kondenzirana formula je c6H5Pogl3 ali phch3 in to je sestavljena iz metilne skupine (ch3) skupaj z benzenskim obročem ali fenilno skupino (pH). Seveda ga najdemo v surovi nafti, v premogu, v vulkanskih emanacijah in v nekaterih drevesih, kot je Tolú de América na jugu.
To značilno vonjsko topilo se uporablja predvsem kot industrijska surovina in kot redčenje barve. Uporablja se tudi pri izločanju parazitov, ki so prisotni pri mačkah in psih, kot so askaridi in anylostomi.
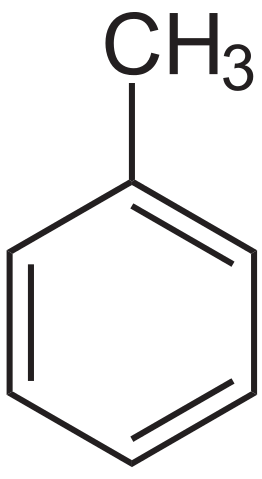
 Toluenska strukturna formula. Vir: Neurotoger prek Wikipedije.
Toluenska strukturna formula. Vir: Neurotoger prek Wikipedije. Toluen sta leta 1837 prvič izolirala Pierre-Joseph Pelletier in Philippe Walter iz Pine Oil. Nato ga je Henri Etienne Sainte-Claire Deville leta 1841 izoliral iz balzama Tolú in poudaril, da je bil njen izdelek podoben prej izolirani. Leta 1843 ga je Berzelius krstil kot Toluin.
Večina toluena dobimo kot bočni ali sekundarni proizvod v procesih proizvodnje plina in pretvorbo premoga v koks. Nastajajo tudi z reakcijami v laboratoriju, na primer reakcija benzena z metil kloridom.
[TOC]
Struktura
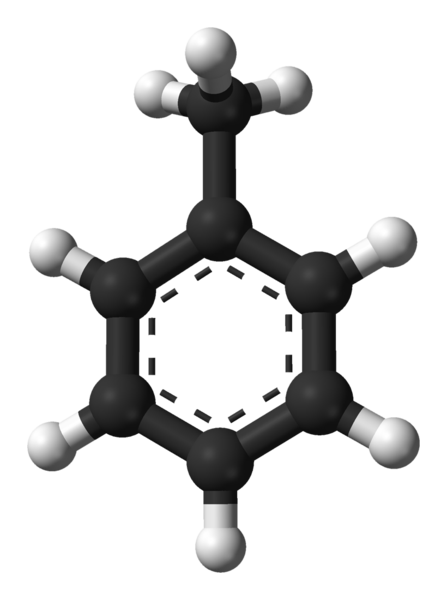 Molekularna struktura toluena. Vir: Ben Mills prek Wikipedije.
Molekularna struktura toluena. Vir: Ben Mills prek Wikipedije. Na vrhunski sliki imamo molekularno strukturo toluena, ki jo predstavlja model sfer in palic. Upoštevajte, da je videti popolnoma enako kot navedena strukturna formula, z razliko, da ni povsem ravna molekula.
V središču benzenskega obroča, ki ga v tem primeru lahko vidimo kot fenilna skupina, pH, je njegov aromatični značaj poudarjen skozi pikčaste črte. Vsi atomi ogljika imajo hibridizacijo SP2, Razen skupine CHO3, čigar hibridizacija je sp3.
Zaradi tega molekula ni povsem ravna: Cho Hydrogens3 Nahajajo se pod različnimi koti benzenske obročne ravnine.
Vam lahko služi: ionizacijska konstantaToluen je apolarna, hidrofobna in aromatična molekula. Njegove medmolekularne interakcije temeljijo na londonskih disperzivnih silah in v interakcijah dipolo-dipolo, saj je središče obroča "naloženo" elektronske gostote, ki jo zagotavlja CH3; Medtem ko imajo vodikovi atomi nizko elektronsko gostoto.
Zato ima toluen več vrst medmolekulskih interakcij, ki ohranjajo molekule njihovega tekočega koheziva. To se odraža v njegovi vrelišču, 111 ° C, kar je visoko, če gre za apolarno topilo.
Lastnosti
Fizični videz
Brezbarvna in prozorna tekočina
Molarna masa
92,141 g/mol
Vonj
Sladka, hektar in podoben kot benzena
Gostota
0,87 g/ml pri 20 ° C
Tališče
-95 ° C
Vrelišče
111 ° C
Topnost
Toluen ima zaničljivo topnost v vodi: 0,52 g/L pri 20 ° C. To zaradi razlike v polarnostih med toluenom in vodo.
Po drugi strani je toluen topen ali v tem primeru mešljiv, z etanolom, benzenom, etilnim etrom, acetonom, kloroformom, ledeniško ocetno kislino in ogljikovim disulfidom; to pomeni, da je bolje solubilizirana v manj polarnih topilih.
Indeks loma (nD)
1.497
Goo
0,590 CP (20 ° C)
točka vžiga
6 ° C. Toluen je treba manipulirati v taboriščih za pridobivanje plina in čim dlje od katerega koli plamena.
Gostota hlapov
3.14 v zračnem razmerju = 1. To pomeni, da so njihovi hlapi trikrat gostejši od zraka.
Parni tlak
2.8 kPa pri 20 ° C (približno 0.27 ATM).
Temperatura samoificiranja
480 ° C
Razgradnja
Lahko močno reagira z oksidacijskimi materiali. Ko se segreje na razgradnjo, oddaja hektar in draži dim.
Površinska napetost
29,46 mn pri 10 ° C
Dipolarni trenutek
0,36 d
Reaktivnost
Toluen je nagnjen k kloriranju za proizvodnjo orto-klorotoluena in para-clorotoluena. Prav tako je enostavno izdelati nitrificirati za proizvodnjo nitrotoluena, ki je surovina barvil.
Vam lahko služi: atomska težaDel toluena je kombiniran s tremi deli dušikove kisline, da povzroči trinitrotoluen (TNT): eden najbolj znanih eksplozivov.
Prav tako toluen doživi sulfonacijo za ustvarjanje o-toluen-sulfonskih in p-toluen-sulfonskih kislin, ki so surovina za proizvodnjo barvil in saharina.
Toluenska metilna skupina doživi izgubo vodika zaradi delovanja močne baze. Tudi metilna skupina je dovzetna za oksidacijo, zato reagira s kalijevim permanganatom, da povzroči benzojsko in benzaldehidno kislino, ki izvira.
Prijave
Industrijalisti
 TNT, najbolj simboličen eksploziven od vseh, se zgodi toluen kot glavni surovi material. Vir: Pixabay.
TNT, najbolj simboličen eksploziven od vseh, se zgodi toluen kot glavni surovi material. Vir: Pixabay. Toluen se uporablja pri izdelavi slik, razredčil barv, poliranih nohtov, lepil ali dlesni paste, lakov, črnil, najlona, plastike, poliuretanske pene, večine olj, vinil organov, zdravil, barvil, parfumov, eksplozivov, eksplozivov (TNT).
Na enak način se toluen uporablja v obliki toluenosulfonadosa pri proizvodnji detergenta. Toluen je zelo pomemben tudi pri izdelavi plastičnih cementov, kozmetičnih obarvanih deležev, antifriz, črnila, asfaltu, trajnih markerjih, kontaktnih cementih itd.
Topilo in razredčilo
Toluen se uporablja pri redčenju slik, ki olajša njegovo uporabo. Uporablja se za raztapljanje robov polistirenskih kompletov, s čimer omogoča združitev delov, ki sestavljajo modele letalskih zrakoplovov. Poleg tega se uporablja pri ekstrakciji naravnih izdelkov iz rastlin.
Toluen je topilo s črnilom, ki se uporablja v gravirani luknji. Cementi, pomešani z gumo in toluenom, se uporabljajo za pokrivanje velikega števila izdelkov. Prav tako se toluen uporablja kot topilo v tiskanih črnilih, lakih, usnjenih usnjah, lepilu in razkužitvi.
Vam lahko služi: molarno absorpcijoIn še bolj zanimivo, toluen se uporablja kot topilo ogljikovih nanomaterialov (na primer nanocevk) in Fullerenosa.
Drugi
V bencin dodamo mešanico benzena, toluena in ksilena (BTX), da se poveča oktana. Toluen je dodatek za plin letala in rezervat z visoko oktano. Uporablja se tudi pri izdelavi NAFTA.
Toluen pomaga pri izločanju nekaterih vrst ascáridov in anquilostomos, pa tudi tenije, ki so zajedavci mačk in psov.
Pridobivanje
Večina toluena dobimo iz destiliranih produktov iz surove nafte, ki nastane med pirolizo ogljikovodika (pare pocket). Katalitična reforma oljnih hlapov predstavlja 87 % proizvedenega toluena.
Dodatnih 9 % toluena iz piroliznega bencina, ki se proizvaja med proizvodnjo etilena in propilena.
Hulla katran iz koksa prispeva 1 % proizvedenega toluena, preostalih 2 %.
Škodljivi učinki
Toluen je topilo, ki se vdihava, da postane visoka, saj ima narkotično delovanje, ki vpliva na delovanje centralnega živčnega sistema. Toluen vstopi v telo za zaužitje, vdihavanje in absorpcijo skozi kožo.
Na stopnji izpostavljenosti 200 ppm, vzbujanju, evforiji, halucinacijah, izkrivljenih zaznavah, glavobolu in omotičnosti. Medtem ko lahko višja raven izpostavljenosti toluenu povzroči depresijo, zaspanost in stupor.
Ko vdihavanje presega koncentracijo 10.000 ppm, lahko povzroči smrt posameznika zaradi odpovedi dihanja.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Nacionalni center za informacije o biotehnologiji. (2020). Toluen. Baza podatkov Pubchem., Cid = 1140. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2020). Toluen. Pridobljeno iz: v.Wikipedija.org
- Engineering Toolbox, (2018). Toluen - Termofizične lastnosti. [Online] Obnovi se od: EngineringToolbox.com
- Vedantu. (s.F.). Toluen. Okreval od: Vedantu.com
- « Formula in enačbe destruktivne interference, primeri, vadba
- Struktura polivinilpiridona, lastnosti, uporabe, neželeni učinki »

