Značilnosti tirozina, struktura, funkcije, prednosti
- 4445
- 152
- Dexter Koch
The Tirozin (Tyr, Y) je ena od 22 aminokislin, ki sestavljajo beljakovine vseh celic, ki so prisotne v živih bitjih. Za razliko od drugih aminokislin, kot so valin, treonin, triptofan, levcin, lizin in drugi, je tirozin "pogojno" v bistvu esencialne aminokisline.
Ime "tirozin" izhaja iz grške besede "Streljanje", kar pomeni sir, ker je bila ta aminokislina prvič odkrita v tej hrani. Izraz je leta 1846 skoval Liebig, ki je mešal sir s kalijevim hidroksidom in dobil neznano spojino, komaj topno v vodi.
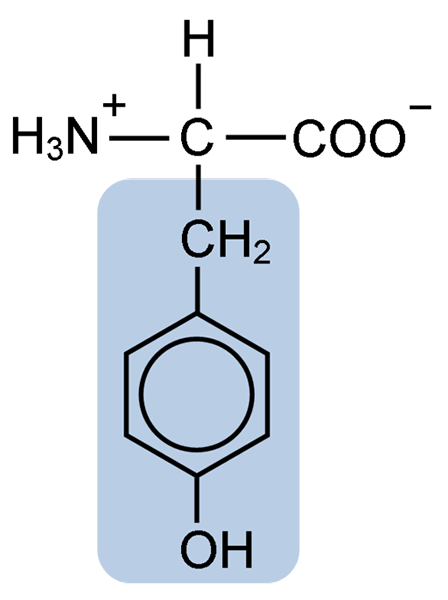
 Kemična struktura tirozin aminokisline (vir: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Kemična struktura tirozin aminokisline (vir: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Po prvotnem opisu so drugi raziskovalci, kot sta Warren de la Rue in Hinterberger, pridobljeni iz kokoidnih žuželk in beljakovin. Njegovo ločevanje od hidrolize drugih beljakovin s klorovodikovo kislino je leta 1901 opisal Mörner.
Na splošno se ta aminokislina dobiva pri sesalcih zahvaljujoč hidroksilaciji fenilalanina, čeprav se v črevesju absorbira tudi iz beljakovin, ki jih zaužijemo s hrano.
Tirozin ima več funkcij v človeškem telesu, med njimi.
[TOC]
Značilnosti
Tirozin tehta približno 180 g/mol, njegova skupina R ali stranska veriga pa ima 10 -disociacijsko konstanto 10.07. Njegova relativna številčnost v celičnih beljakovinah ne presega 4%, ampak ima več bistvenih funkcij za človeško fiziologijo.
Ta aminokislina spada v skupino aromatičnih aminokislin, v katerih sta tudi fenilalanin in triptofan. Člani te skupine imajo aromatične obroče v svojih r r ali stranskih verigah in ponavadi so hidrofobne ali apolarne aminokisline.
Tako kot triptofan tudi tirozin absorbira ultravijolično svetlobo in je eden izmed aminokislinskih odpadkov, ki so odgovorni za absorbanco svetlobe do 280 nm številnih beljakovin, zato je uporaben za njegovo karakterizacijo.
Zdi se, da je bistvena "pogojno" aminokislina, saj je njegova biosinteza pri človeku odvisna od fenilalanina, esencialne aminokisline. Če telo izpolnjuje svoje vsakodnevne zahteve fenilalanina, lahko tirozin sintetiziramo brez težav in ni omejevanje aminokisline.
Če pa prehrane primanjkuje fenilalanina, telo ne bo imelo le neravnovesja te aminokisline, ampak tudi tirozina. Pomembno je tudi poudariti, da reakcija sinteze tirozina iz fenilalanina ni reverzibilna, zato tirozin ne more ustrezati celičnim potrebam fenilalanina.
Tirozin spada tudi v aminokislinsko skupino z dvojnimi funkcijami pri proizvodnji glukogenih in ketogenih presnovnih posrednikov, ki sodelujejo pri sintezi glukoze za možgane in na tvorbi ketonskih teles v jetrih.
Struktura
Tako kot ostale aminokisline, tirozin ali β-parahidroksifenil-α-amino propionsko kislino, je α-aminokislina, ki ima osrednji atom ogljika, imenovan ogljik α in ki je kiralna, ker je povezan štirje različni nadomestni atomi ali molekule.
Ta Quiralni ogljik je povezan z dvema značilnima skupinama aminokislin: amino skupino (NH2) in karboksilno skupino (COOH). Eno od svojih vezi si deli tudi z atomom vodika, preostalo vez pa zaseda R ali stranska veriga vsake aminokisline.
V primeru tirozina je ta skupina sestavljena iz aromatičnega obroča, povezanega s hidroksilno (OH) skupino, ki mu daje sposobnost oblikovanja vodikovih mostov z drugimi molekulami in ki mu daje bistvene funkcionalne značilnosti za nekatere encime.
Lahko vam služi: baroreceptorjiFunkcije
Tirozin je temeljna sestavina številnih beljakovin z veliko raznolikostjo bioloških dejavnosti in funkcij.
Pri ljudeh in drugih sesalcih se ta aminokislina izkoristi v živčnih in ledvičnih tkivih za sintezo dopamina, adrenalina in norepinefrina, treh kateholaminergikov, povezanih.
Ključnega pomena je tudi za sintezo ultravijoličnih ščitnikov za sevanje (UV), kot je melanin; nekaterih analgetikov, kot so molekule endorfinov in antioksidantov, kot je vitamin E.
Podobno ta aminokislina služi za sintezo tiramina, oktopamina in ščitničnih hormonov z organizacijo joda v ostanku tirozina v tirozinu.
Tiramin je vazoaktivna molekula, ki jo najdemo v človeškem telesu in hobotin je amin, povezan z noreprenalinom.
Vse te funkcije tirozina so možne zahvaljujoč pridobivanju beljakovin prehrane ali hidroksilacije fenilalanina z jetri.
Funkcije v rastlinah
Tirozin in nekateri posredniki, ustvarjeni med njihovo biosintezo, nahranijo biosintetske poti presnovkov, specializiranih za obrambo, privlačnost opraševalcev, v elektronski transport in strukturno podporo.
Biosinteza
V človeku tirozin dobimo iz prehrane ali sintetiziramo v enem koraku z jetrnimi celicami iz fenilalanina, esencialne aminokisline, z reakcijo, ki jo katalizira encimski kompleks fenilalanin hidroksilaze.
Ta kompleks ima aktivnost oksigenaze in je prisoten le v jetrih ljudi ali drugih sesalcev. Reakcija sinteze tirozina torej pomeni prenos atoma kisika v položaj za aromatičnega obroča fenilalanina.
Ta reakcija se pojavi istočasno, ko nastane molekula vode zaradi zmanjšanja drugega molekularnega kisikovega atoma, reducirajočo moč pa neposredno prispeva NADPH, konjugiran s tetrahidroprinino molekulo, ki je podobna folilni kislini.
Biosinteza v rastlinah
V rastlinah se sintetizira tirozin od Nove Dolgovodno pot "Shikimato", ki napaja druge biosintetske poti drugih aromatičnih aminokislin, kot sta fenilalanin in triptofan.
V teh organizmih sinteza temelji na spojini, znani kot "Corismato", ki je končni produkt Shikimatojeve poti, poleg tega.
Korizmat se pretvori v predgovor s katalitičnim delovanjem encima Mutasa Corismata in to je prvi "zavzet" korak v sintezi tirozina in fenilalanina v rastlinah.
Predineat se pretvori v tirozin z oksidativno dekarboksilacijo in transaminacijo, ki se lahko pojavi v poljubnem vrstnem redu.
V eni od biosintetskih poti lahko te korake kataliziramo s specifičnimi encimi, znanimi kot prefenat-specifični dehidrogenaza (PDH) (ki pretvori predgovor v 4-hidroksifenilpinilezo oziroma.
Druga pot sinteze tirozina iz predgovora pomeni transaminacijo predineata v neproteinogeno aminokislino, imenovano L-Arogenat, katalizirano z encimom prednatno aminotransferazo.
L-Arogenat je naknadno podvržen oksidativni dekarboksilaciji, da tvori tiroksin, reakcija, ki jo usmerja encim tirozin, specifično za dehidrogenazo, znano tudi kot ADH.
Rastline prednostno uporabljajo pot Arenata, večina mikrobov pa sintetizira tirozin iz HPP, pridobljenega iz predenesata.
Uredba
Kot velja za večino biosintetskih poti aminokislin, imajo rastline strog sistem regulacije sinteze aromatičnih aminokislin, vključno s tirozinom.
Vam lahko služi: Okusna pošast: značilnosti, habitat, nega, lastnostiV teh organizmih se regulacija pojavlja na številnih ravneh, saj mehanizmi, ki nadzorujejo Shikimato pot.
Vendar so zahteve tirozina in torej togost pri regulaciji njihove biosinteze značilne za vsako rastlinsko vrsto.
Degradacija
Degradacija ali katabolizem tirozina povzroči nastanek fumarata in acetoacetata. Prvi korak te poti je v pretvorbi aminokisline v 4-hidroksifenilpippat s citosolnim encimom, znanim kot aminotransferaza tirozin.
To aminokislino lahko v mitohondrijih hepatocitov preženemo tudi z encimom aminotransferaze aspartata, čeprav ta encim v normalnih fizioloških pogojih ni zelo pomemben.
Z razgradnjo tirozina se lahko pojavi sukcinil-acetoacetat, ki ga lahko dekarboksiliramo za sukcinil-acetat. Sukcinil-acetat je najmočnejši zaviralec encimov, odgovoren za sintezo hemo skupine, 5-aminolevulinske kisline dehidrataze.
Sinteza adrenalina in norepinefrina
Kot rečeno, je tirozin eden glavnih substratov za sintezo dveh zelo pomembnih nevrotransmiterjev za človeško telo: adrenalin in norepinefrin.
To sprva uporablja encim, znan kot tirozin hidroksilaze, ki lahko doda dodatno hidroksilno skupino aromatičnemu obroču skupine RI tirozin R, ki tvori spojino, znano kot DOPA.
DOPA povzroča dopamin, ko ga encim encim dopa decboxilas obdela encim.
Dopamin se nato pretvori v noreprenalin z delovanjem encima dopamina β -oksidaze, ki katalizira dodajanje hidroksilne skupine v -CH, ki je bila del skupine R tirozina in ki deluje kot "most" med aromatičnim obročem in ogljik α.
Adrenalin izhaja iz norepinefrina z delovanjem fenitanolamina N-Metiltransferaza, ki je odgovorna za S-adenozil-metiin-odvisen prenos metilne skupine (-CH3) v brezplačno amino skupino norepinefrina.
Živila, bogata s tirozinom
Kot že omenjeno, je tirozin bistvena "pogojno" aminokislina, saj se v človeškem telesu sintetizira s hidroksilacijo fenilalanina, esencialne aminokisline.
Če torej vnos fenilalanina pokriva potrebe telesa, tirozin ni omejujoč dejavnik za normalno delovanje celic. Tirozin pa je pridobljen tudi od beljakovin, ki jih uživamo z dnevno hrano.
Nekatere študije poročajo, da naj bi bil minimalni dnevni vnos tirozina in fenilalanina med 25 in 30 mg na kilogram teže, zato bi moral povprečen človek zaužiti več ali manj 875 mg tirozina na dan.
Živila z višjo vsebnostjo tirozina so sir in soja. Med njimi so tudi govedina, jagnjetina, svinjina, piščanec in ribe.
Nekatera semena in oreščki, kot so oreščki, prav tako dajejo pomemben prispevek te aminokisline, pa tudi jajca, mlečne izdelke, zrna in žita.
Prednosti vašega vnosa
Tirozin se običajno porabi v obliki prehranskih ali prehranskih dopolnil, zlasti za zdravljenje patologije, znane kot fenilcetonurija, ki jo trpijo bolniki, ki ne morejo pravilno predelati fenilalanina in zato ne proizvajajo tirozina.
Lahko vam služi: funkcija odnosovMenijo, da lahko povečanje količine porabljenega tirozina na dan izboljša kognitivne funkcije, povezane z učenjem, spominom in opozorilom v stresnih pogojih.
Nekateri ljudje jemljejo tablete, ki so tirosin, da ostanejo pozorni čez dan, če so izgubili veliko ur spanja.
Ker ta aminokislina sodeluje pri tvorbi ščitničnega hormona, lahko njegova poraba pozitivno vpliva na sistemsko presnovno regulacijo.
Motnje pomanjkanja
Albinizem in alcaptonarija sta dve patologiji, povezani s presnovo tirozina. Prvi pogoj je povezan s pokvarjeno sintezo melanina iz tirozina, drugi pa je povezan z napakami pri razgradnji tirozina.
Za albinizem je značilno pomanjkanje pigmentacije v koži, to je bolniki, ki trpijo za njim.
Ta patologija je povezana s pomanjkanjem specifične tirozinaze melanocitov, ki je odgovorna za pretvorbo tirozina v dopa-kinon, posrednik v sintezi melanina.
Simptomi alcaptonurije so očitni kot pretirana pigmentacija urina (temna) in pozni razvoj artritisa.
Druge presnovne patologije
Poleg tega obstajajo druge motnje, povezane s presnovo tirozina, med katerimi so:
- Dedna tirozinemija tipa I: za katero je značilna progresivna degeneracija jeter in ledvična disfunkcija
- Dedna tirozinemija sindroma tipa II ali Richner-Hanharta: kar je očitno kot keratitis in ampularni leziji v dlani in podplatih stopal
- Tirosinemija tipa III: ki je lahko asimptomatska ali prisotna kot duševne zamude
- "Hawkinsinuria": za katero je značilna presnovna acidoza v otroštvu in nezmožnost uspešnosti pri rasti
Obstajajo tudi druge prirojene okvare v metrozinskem presnovi, ki so povezane s pomanjkanjem encimov, ki so odgovorni za njihovo razgradnjo, kot je hidroksilaza tirozin, zadolžena za prvi korak sinteze dopamina iz tirozina.
Reference
- Aders Plimmer, r. (1908). Kemična ustava beljakovin. odšel sem. London, Velika Britanija: Longmans, Green in Co.
- Chakrapani, a., Gissen, str., & McKiernan, P. (2012). Motnje metabolizma tirozina. V Začela presnovna želja: diagnoza in zdravljenje (str. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Nekateri vidiki presnove tirozina pri mladih. Yo. Razvoj sistema oksidacije tirozina v človeških jetrih. Časopis za klinično preiskavo, 35(10), 1089-1093.
- Du, b., Zannoni, v., Laster, l., & Seegmiller, e. (1958). Narava napake pri presnovi tirozina v alkaptonuriji. Časopis za biološko kemijo, 230, 251-260.
- Murray, r., Bender, d., Botham, k., Kennelly, str., Rodwell, v., & Weil, P. (2009). Harperjeva ilustrirana biokemija (28. izd.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehningerjeva načela biokemije. Omega izdaje (5. izd.).
- Schenck, c. Do., & Maeda, h. Do. (2018). Tirozinska biosinteza, presnova in katabolizem v rastlinah. Fitokemija, 149, 82-102.
- Slominski, a., ZMijewski, m. Do., & Paweley, J. (2012). L-tirozin in L-dihidroksifenilalanin kot hormonsko podobni regulatorji funkcij melanocitov. Raziskave pigmentnih celic in melanoma, 25(1), 14–27.
- Van de, g. (2018). Zdravstvena linija. Pridobljeno 16. septembra 2019 z www.Zdravstvena linija.com
- MD splet. (n.d.). Pridobljeno 15. septembra 2019 z www.Webmd.com
- Whitbread, d. (2019). Moji podatki o hrani. Pridobljeno 15. septembra 2019 z www.Myfooddata.com

