Termokemija

- 3630
- 741
- Cary Goyette
Pojasnjujemo, da gre za termokemijo, kakšne študije, njene zakone in aplikacije
 V termokemiji se v kemijskih reakcijah preučujejo spremembe toplote
V termokemiji se v kemijskih reakcijah preučujejo spremembe toplote Kaj je termokemija?
The Termokemija Odgovoren je za preučevanje toplotnih sprememb, ki se izvajajo v reakcijah med dvema ali več kemičnimi vrstami. Šteje se za bistveni del termodinamike, ki preučuje preoblikovanje toplote in drugih vrst energije, da bi razumel smer, v kateri se razvijajo procesi, in kako se njena energija razlikuje.
Ključnega pomena je tudi razumeti, da toplota vključuje prenos toplotne energije, ki se pojavi med dvema telesi, ko sta ta pri različnih temperaturah; Medtem ko je toplotna energija povezana z naključnim gibanjem, ki ga imajo atomi in molekule.
Ker se skoraj vse kemijske reakcije energija absorbira ali sprošča s toploto, je analiza pojavov, ki se pojavljajo skozi termokemijo, zelo pomembna.
Kaj študira termokemijo?
Thermokemija preučuje spremembe toplote v obliki toplote, ki se pojavijo v kemičnih reakcijah, ali ko pride do procesov, ki pomenijo fizične transformacije.
V tem smislu je treba v temi razjasniti nekatere koncepte za večje razumevanje istega.
Sistem
Na primer, izraz "sistem" se nanaša na poseben segment vesolja, ki ga preučujemo, pri čemer ga razumemo kot "vesolje", upoštevanje sistema in njene okolice (vse je zunaj).
Torej sistem običajno sestavlja vrsta, ki sodelujejo v kemičnih ali fizikalnih transformacijah, ki se pojavijo v reakcijah. Te sisteme lahko razvrstimo v tri vrste: odprte, zaprte in izolirane:
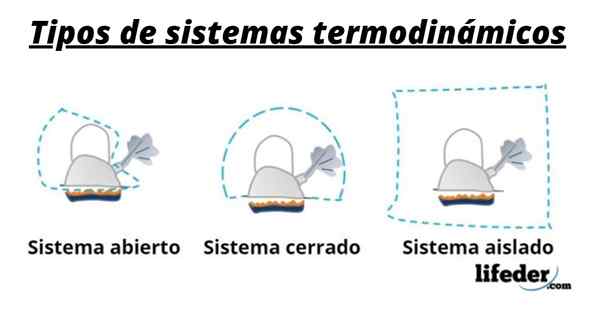
- Odprti sistem je tisti, ki omogoča prenos snovi in energije (toplote) z okolico.
- V zaprtem sistemu obstaja izmenjava energije, vendar ne snovi.
- V izoliranem sistemu prenos snovi ali energije v obliki toplote ni predstavljen. Ti sistemi so znani tudi kot "adiabatski".
Zakoni o termokemiji
 Germain Hess, ustvarjalec Hessovega zakona, temeljni za termokemijo
Germain Hess, ustvarjalec Hessovega zakona, temeljni za termokemijo Zakoni termokemije so tesno povezani z Laplaceom in Lavoisierjevim zakonom ter Hessovim zakonom, ki so predhodniki prvega zakona termodinamike.
Načelo, ki ga je določil francoski Antoine Lavoisier (pomembna kemična in plemenita) in Pierre-Simon Laplace (znani matematik, fizični in astronomski velikost v nasprotju s spremembo energije obratne reakcije ".
Hess zakon
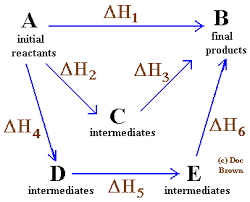
 Preprost in splošen diagram, kjer se uporablja zakon Hess za štiri kemijske reakcije
Preprost in splošen diagram, kjer se uporablja zakon Hess za štiri kemijske reakcije V istem vrstnem redu idej je zakon, ki ga je oblikoval ruski kemik iz Švice, Germain Hess, temelj za razlago termokemije.
To načelo temelji na njegovi razlagi zakona o ohranjanju energije, ki se nanaša na dejstvo, da energije ni mogoče ustvariti ali uničiti, samo preoblikovati.
Hessov zakon je mogoče razglasiti na ta način: "Skupna entalpija v kemični reakciji je enaka, ali se reakcija izvede v enem koraku, kot da se zgodi v zaporedju več korakov".
Skupna entalpija se pojavi kot odštevanje med vsoto entalpije produktov, razen vsote entalpije reaktantov.
V primeru spremembe standardne entalpije sistema (v standardnih pogojih 25 ° C in 1 atm) ga je mogoče shematizirati glede na naslednjo reakcijo:
Vam lahko služi: klorogena kislinaΔHreakcija = ΣΔH(Izdelki) - ΣΔH(reaktanti)
Drug način za razlago tega načela, če vemo, da se sprememba entalpije nanaša na spremembo toplote v reakcijah, ko jih dajemo stalen pritisk sledi med začetnim stanjem in koncem.
Prvi zakon termodinamike
Ta zakon je tako intrinzično povezan s termokemijo, da je včasih zmeden, katerega je navdihnil drugega; Torej, če želite dati luči na ta zakon.
Tako da termodinamika ne upošteva samo toplote kot oblike prenosa energije (kot je termokemija), ampak vključuje tudi druge oblike energije, kot je notranja energija (Ali).
Torej je sprememba notranje energije sistema (ΔU) podana z razliko med njegovim začetnim in končnim stanjem (kot je razvidno iz zakona o HESS).
Ob upoštevanju, da je notranja energija sestavljena iz kinetične energije (gibanje delcev) in potencialne energije (interakcije med delci) istega sistema, je mogoče sklepati, da obstajajo tudi drugi dejavniki, ki prispevajo k preučevanju stanja in lastnosti vsakega sistema.
Vloge za termokemijo
Termokemija ima več aplikacij, nekatere od njih bodo omenjene spodaj:
- Določitev sprememb energije v določenih reakcijah z uporabo kalorimetrije (merjenje sprememb toplote v določenih izoliranih sistemih).
- Odbitek entalpijskih sprememb v sistemu, tudi če jih ni mogoče poznati z neposrednim merjenjem.
- Analiza toplotnih prenosov, ki nastanejo eksperimentalno, ko se oblikujejo organometalne spojine s prehodnimi kovinami.
- Študija energijskih transformacij (v toploti), podanih v spojinah koordinacije poliaminov s kovinami.
- Določitev entalpije kovinsko-kisikovega vez β-DICS in β-DICS združenih s kovinami.
- Kot tudi v prejšnjih aplikacijah lahko termokemijo uporabimo za določitev velikega števila parametrov, povezanih z drugimi vrstami energije ali državnih funkcij, ki so tiste, ki v določenem času definirajo status sistema.
- Termokemija se uporablja tudi pri preučevanju številnih sestavljenih lastnosti, kot pri titracijski kalorimetriji.
Reference
- Wikipedija. (s.F.). Termokemija. Pridobljeno iz.Wikipedija.org
- Chang, R. (2007). Kemija, deveta izdaja. Mehika: McGraw-Hill.
- Librettexts. (s.F.). Termokemija - pregled. Pridobljeno iz kem.Librettexts.org
- Tyagi, str. (2006). Termokemija. Okrevano iz knjig.Google.co.pojdi
- Ribeiro, m. Do. (2012). Termokemija in njene uporabe za kemične in biokemijske sisteme. Pridobljeno iz knjig.Google.co.pojdi
- Singh, n. B., Das, s. S., In Singh,. K. (2009). Fizikalna kemija, letnik 2. Okrevano iz knjig.Google.co.pojdi

