Etilni eter

- 4561
- 506
- Stuart Armstrong
 Etilni eter je hlapna in vnetljiva tekočina, ki je služila kot anestetik v devetnajstem stoletju
Etilni eter je hlapna in vnetljiva tekočina, ki je služila kot anestetik v devetnajstem stoletju Kaj je etilni eter?
On etilni eter, Znan tudi kot dietingl eter, je organska spojina, katere kemijska formula je c4H10Tudi. Zanj je značilno, da je brezbarvna in nestanovitna tekočina, zato je treba njegove steklenice čim bolj tesno zaprti.
Ta eter. To pomeni, da imajo ror formulo ', kjer r in r' predstavljata različne gazirane segmente. In kot je opisano z njegovim drugim imenom Dietyl Ether, sta dva radikala -etil, ki sta povezana z atomom kisika.
Sprva je etilni eter uporabil kot splošni anestetik, ki ga je leta 1846 uvedel William Thomas Green Morton. Vendar je bila zaradi svoje vnetljivosti njena uporaba zavržena in jo nadomestila z drugimi manj nevarnimi anestetiki.
Ta spojina je bila uporabljena tudi za izračun časa krvnega obtoka, med oceno kardiovaskularnega statusa bolnika.
Struktura etilnega etra
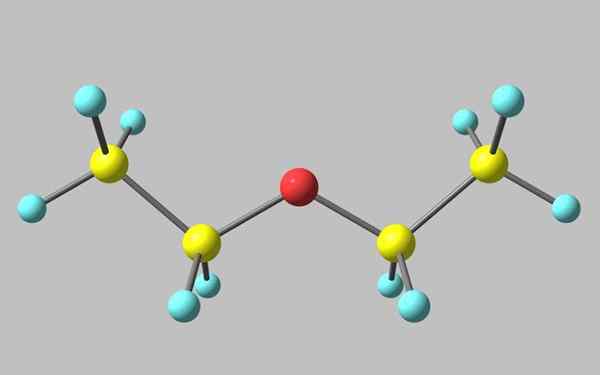 Kemična struktura etilnega etra
Kemična struktura etilnega etra Na vrhunski sliki je predstavitev z modelom kroglic in palic molekularne strukture etil etra.
Kot je razvidno, ima rdeča krogla, ki ustreza atomu kisika, dve etilni skupini, povezani z obema stranema. Vse povezave so preproste, fleksibilne in proste vrtenja okoli osi σ.
Te rotacije izvirajo iz stereoizomerov, znanih kot konformerji, ki so več kot izomeri alternativna prostorska stanja. Struktura slike natančno ustreza antikonformnemu, v katerem so vse njene atomske skupine zamaknjene (ločene drug od drugega).
Drugi Confruero je zasenčen, in čeprav ni njegova razpoložljiva podoba, je dovolj, da ga vizualiziramo z U -Shaped. Na zgornjih koncih bi se nahajale metilne skupine, -ch3, ki bi doživeli sterične odbojnosti (trčili bi v vesolju).
Vam lahko služi: Faraday ConstantZato je mogoče pričakovati, da je molekula Cho3Pogl2Och2Pogl3 sprejemanje proti tvorbi večino časa.
Fizikalne in kemijske lastnosti etilni eter
Druga imena
- Dietilni eter
- Etoksitano
- Etil oksid
Molekularna formula
C4H10O o (c2H5)2Tudi.
Molekularna teža
74.14 g/mol.
Fizični videz
Brezbarvna tekočina.
Vonj
Sladko in začinjeno.
Okus
Gorijo in sladko.
Vrelišče
94.3 ° F (34.6 ° C) pri 760 mm Hg.
Tališče
-177.3 ° F (-116.3 ° C). Stabilni kristali.
točka vžiga
-49 ° F (zaprta posoda).
Topnost vode
6.04 g/100 ml pri 25 ° C.
Topnost v drugih tekočinah
Mešljivo s kratko verižno alifatsko, benzenom, kloroformom, oljnim etrom, maščobnim topilom, številnimi olji in koncentrirano klorovodikovo kislino.
Topno v acetonu in zelo topno v etanolu. Topno je tudi v bencinu, benzenu in oljih.
Gostota
0.714 mg/ml pri 68 ° F (20 ° C).
Gostota pare
2.55 (glede na zrak z gostoto 1).
Parni tlak
442 mm Hg pri 68 ° F. 538 mm Hg pri 25 ° C. 58,6 kPa pri 20 ° C.
Stabilnost
Počasi se oksidira z delovanjem zraka, vlažnosti in svetlobe s tvorbo peroksidov.
Oblikovanje peroksidov se lahko pojavi v eterskih posodah, ki so odprte in ostanejo v skladišču več kot šest mesecev. Peroksidi lahko sprožijo trenje, udarce ali ogrevanje.
Njegov stik z: cinkom, halogeni, ne -metalnimi oksihaluros, močna oksidacijska sredstva, kromil klorid, treeminski olji, nitrati in kovinski kloridi.
Samožitev
356 ° F (180 ° C).
Razgradnja
Ko se ogreje, se pokvari, oddaja hektar in draži dim.
Goo
0.2448 Poise pri 20 ° C.
Toplota zgorevanja
8.807 kcal/g.
Lahko vam služi: Einstenio (S): struktura, lastnosti, pridobivanje, uporabeToplota za uparjanje
89.8 apna/g a 30 ° C.
Površinska napetost
17.06 Dynas/cm pri 20 ° C.
Ionizacijski potencial
9.53 ev.
Prag vonja
0.83 ppm (čistost ni podana).
Lomni količnik
1.355 do 15 ° C.
Pridobivanje etilni eter
V prisotnosti žveplove kisline kot katalizatorja lahko dobimo etil eter iz etilnega alkohola v prisotnosti žveplove kisline. Žveplova kislina v vodnem mediju disociira, ki proizvaja hidronijev ion, H3Tudi+.
V nasprotnem postopku, to je hidracija etilena v parni fazi, se lahko etilni eter poleg etilnega alkohola tvori kot kolateralni produkt. Pravzaprav ta sintetična pot ustvari večino te organske spojine.
Toksičnost etilni eter
Lahko povzroči draženje kože in oči. Kožni stik lahko ustvari svojo resekcijo in razpoka. Eter običajno ne prodre na kožo, saj hitro izhlapi.
Draženje oči, ki jih povzroča eter.
Njegovo zaužitje povzroča narkotične učinke in draženje želodca. Hudo zaužitje lahko povzroči poškodbe ledvic.
Vdihavanje etra lahko povzroči draženje nosu in grla. V primeru inhalacije etra ga lahko ustvarimo: zaspanost, vznemirjenje, omotica, bruhanje, nepravilno dihanje in povečano slinjenje.
Visoka izpostavljenost lahko povzroči izgubo znanja in celo smrt.
OSHA vzpostavi mejo izpostavljenosti delovne sile v povprečju 800 ppm med 8 do uri.
Ravni draženja oči: 100 ppm (ljudje). Ravni draženja oči: 1200 mg/m3 (400 ppm).
Uporaba/aplikacije etilni eter
Organsko topilo
Gre za organsko topilo, ki se uporablja za raztapljanje broma, joda in drugih halogenov. Večina lipidov (maščob), smole, čiste gume, nekaj alkaloidov, gume, parfumi, celulozni acetat, celulozni nitrat, ogljikovodiki in barvila.
Lahko vam služi: brez kovin: zgodovina, lastnosti, skupine, uporabePoleg tega se uporablja pri ekstrakciji aktivnih sestavin živali in rastlinskih tkiv, ker ima manj gostote kot voda in lebdi na njej, tako da želene snovi raztopijo v etru.
Splošna anestezija
Od leta 1840 se uporablja kot splošni anestetik, ki nadomešča kloroform za terapevtsko prednost. Vendar gre za vnetljivo snov in zato najdejo hude težave pri uporabi na kliničnih območjih.
Poleg tega pri bolnikih pri bolnikih proizvede nekatere nezaželene pooperativne stranske učinke, kot sta slabost in bruhanje.
Zaradi teh razlogov je bila uporaba etra zavržena kot splošni anestetik, ki jo nadomešča z drugimi anestetiki, kot je halotano.
Eterski duh
Eter mešani etanol.
Ocena krvnega obtoka
Eter je bil uporabljen za oceno krvnega obtoka med eno roko in pljuči. Eter se vbrizga v roko, odpelje kri v desni atrij, nato v desni prekat in od tam do pljuč.
Čas, ki preteče od injiciranja etra, do zajemanja vonja etra v izdihanem zraku, je približno 4 do 6 s.
Poučevanje laboratorijev
Eter se uporablja pri poučevanju laboratorijev v številnih poskusih. Na primer v predstavitvi Mendelovih zakonov genetike.
Eter se uporablja za omrtvičenje spolov Drosophila in omogočite potrebne križe med njimi, da izpostavijo zakone genetike.
Reference
- Graham Solomons t.W., Craig b. Fryhle. Organska kemija. Amine. Wiley Plus.
- Ether eter. Okreval od Britannice.com

