Sistemi teorije trka, energija, primeri
- 4665
- 331
- Don Nitzsche
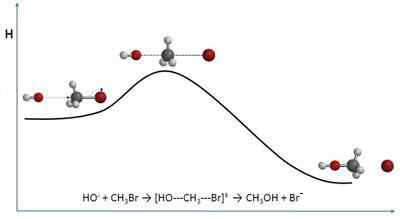
The Teorija trka Pojasnite hitrosti kemijskih reakcij z zgolj molekularne perspektive. Zato je tesno blizu kemične kinetike. Namesto da bi se približali hitrosti v smislu koncentracij, to počne na podlagi frekvenc trka.
Ko govorimo o trkih, lahko podoba nekaterih biljardnih kroglic pride na misel, ki med seboj vpliva na mizo. Vendar pa molekule, čeprav ta teorija predvideva, da so njegove oblike sferične, se ne obnašajo podobno. Molekularni trki se razlikujejo na več načinov, tako prostorske kot energije.

Ta teorija, čeprav je lahko matematično nekoliko zapletena in kaže velike različice glede eksperimentalnih rezultatov, ponuja podobo vidnih razlag in brez abstraktnih vidikov.
Čeprav se uporablja za plinaste sisteme ali zelo razredčene raztopine, se lahko njegova načela razširijo na kakršno koli reakcijo in fizično medij.
[TOC]
Pogoji za reakcije
V skladu s teorijo trkov obstajajo trije pogoji za reakcije:
- Kemične vrste (ioni, molekule, radikali itd.) Učinkovito se morajo trčiti.
- Nositi morajo dovolj energije za razčlenitev povezav.
- Poleg tega mora biti orientacija vpliva zelo specifična.
Molekularni trki
 Kot pri kegljanju se tudi reakcije potekajo le, kadar se učinkovito trčejo v smislu energije in napotkov
Kot pri kegljanju se tudi reakcije potekajo le, kadar se učinkovito trčejo v smislu energije in napotkov Molekularni trki imajo nekaj skupnega z makroskopskim: pojavljajo se pretežno med dvema vrstama ali telesi. Dve biljardni žogi se spopadata drug z drugim, pa tudi nogometno žogo ob steni ali dva izstrelka sredi zraka. To pomeni, da so trki glede kemije in njegovih reakcij bimolekularni tip.
Vam lahko služi: ionizacija v fiziki in kemiji: koncept, proces in primeriMolekule še niso, vendar se premikajo in se vrtijo skozi prostor, ki jih obdaja. Pri tem se domneva, da narišejo nekakšen krog, imenovan presek, na katerem obstaja verjetnost, da bo še ena molekula Colison. Prav tako teorija meni, da so molekule sferične za poenostavitev matematičnih modelov.
Dve molekuli, hipotetično sferični, se lahko trčita brez težav, tudi če ni kemične reakcije. Vendar se ne zgodi na enak način, ko gre za tri, štiri ali več molekul.
Več vrst bi se morale trčiti, da bi nastale, bolj verjetno postane pojav. To je vizualno razloženo, ko poskusite, da se tri kroglice ali izstrelki hkrati trčijo. Zato so bimolekularni trki daleč najpogostejši.
Sistemi
Teorija trka velja samo za programske sisteme ali faze. To je zato, ker plini kažejo na vedenje, ki ga lahko dobro opiše njihova kinetika.
Za tekoče faze ali zelo razredčene raztopine so reaktivne vrste zavite v kletko molekulcev topila, s katero se tudi trčijo. To spreminja panoramo, saj reakcije niso odvisne samo od frekvenc trkov, ampak tudi od difuzije molekul reaktantov skozi medij.
Energije trka
Molekule se lahko trčijo počasi ali zelo hitro. To je odvisno od tega, kako velika je njegova energija, ki se posledično močno razlikuje glede na temperaturo. Močnejši trk je, verjetnost, da pride do kemijske reakcije, se bo povečala, saj lahko ta energija prekine potrebne povezave, da tvori nove.
Vam lahko služi: monomeriTa energija je znana kot aktivacija inDo, In je značilna za kakršno koli kemijsko reakcijo. Ko se temperatura zviša, se povprečje molekul lahko ujema ali presega EDo, Tako se poveča število učinkovitih trkov in zato oblikovani izdelki.
V prisotnosti katalizatorja inDo zmanjšuje, saj zagotavlja površine in elektronska sredstva, ki koristijo trki. Rezultat: Hitrost reakcije se poveča, ne da bi povečala temperaturo ali dodajala druge reagente.
Stericni faktor
Kemične vrste se učinkovito trčijo, da reagirajo in napovedujejo to teorijo, kakšna bo hitrost njihovih reakcij. Vendar so poskusi pokazali, da bolj kot so zapletene strukture reagentov, večja so odstopanja ali razlike med teoretično in eksperimentalno hitrostjo.
To je zato, ker molekule še zdaleč niso sferične, vendar imajo prostorsko vse vrste geometrij. Tu vstopi stericni faktor, ρ, S katerim želi popraviti reakcijske hitrosti, tako da so napovedi teorije z eksperimentalnimi rezultati boljša.
Primeri reakcij
Bimolekularna reakcija
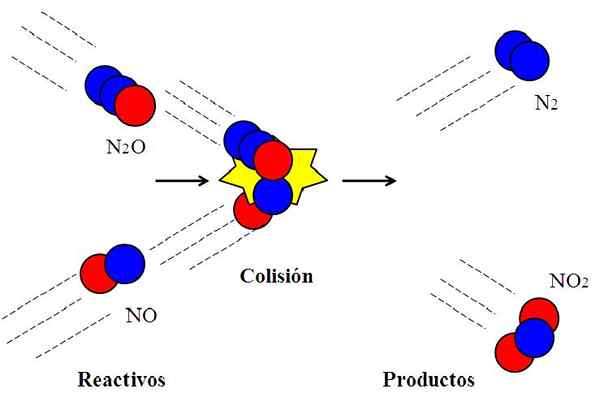 Učinkovit trk med dušikovimi oksidi. Vir: Gabriel Bolívar.
Učinkovit trk med dušikovimi oksidi. Vir: Gabriel Bolívar. Naslednja reakcija:
N2O + ne → n2 + Ne2
Običajno se uporablja za razlago, kaj pomeni učinkovita orientacija pri molekularnih trkih.
Molekula n2Ali, diitrogeni oksid, ne bo reagiral z NO, dušikovega oksida, razen če med trkom atom kisika (rdeči krog) N2Ali šok neposredno z dušikovim atomom (modri krog) št. Samo na ta način bodo izdelki n izvirali2 in ne2; V nasprotnem primeru n molekule2O in ne bodo odskočili, ne da bi reagirali.
Vam lahko služi: plinasta država: značilnosti, splošni zakon, primeriTo je primer bimolekularnega trka za osnovno bimolekularno reakcijo. Tudi če imajo reagenti dovolj energije za prekinitev povezav, če orientacija ni primerna, ne bo kemične reakcije.
Unimolekularna reakcija
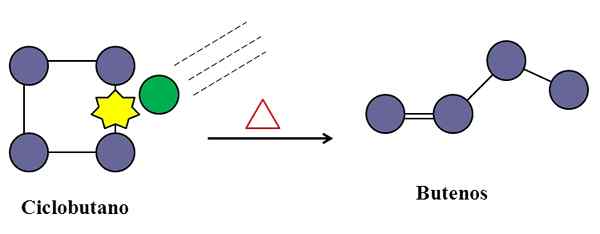 Trki so nepogrešljivi tudi za izomerizacijo ciklobutana. Vir: Gabriel Bolívar.
Trki so nepogrešljivi tudi za izomerizacijo ciklobutana. Vir: Gabriel Bolívar. V nemolekularni osnovni reakciji lahko posredujejo tudi molekularni trki, tudi če gre samo za vrsto, ki trpi.
Razmislite na primer izomerizacijo ciklobutana, da povzroči mešanico butanov. Ko se temperatura zviša, bodo ciklobutanske molekule vibrirale pri višjih frekvencah in trkale z večjo silo. Izdelki pa kažejo, da dve ciklobutanski molekuli ne reagirata drug na drugega, ker bi drugače proizvedla spojino z osmimi ogljikovimi ogljiki.
Na sredini so lahko nečistoče (zeleni krog), ki prav tako trčijo v ciklobutan, zlasti na kateri koli od njegovih C-C povezav. To so lahko plemeniti plini ali ne zelo reaktivne molekule, kot je dušik.
Prišel bo čas, ko bo nečistoča trčila z zadostno energijo, da bi prekinila eno od C-C povezav ciklobutana. In potem bo njegova molekula poskušala preurediti in izvirati buuten, prepoznaven zaradi dvojne vezi in strukture linearne verige.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Glasstone. (1970). Pogodba o fizikalniku. Aguilar s. Do. iz Editions, Juan Bravo, 38, Madrid (Španija).
- Walter J. Moore. (1962). Fizikalna kemija. (Četrta izdaja). Longmans.
- Wikipedija. (2020). Teorija trka. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (2020). Teorija trka. Britannica Encyclopeedia. Okrevano od: Britannica.com
- Clark Jim. (2018). Teorija kolizij reakcijske stopnje. Okrevano od: Chemguide.co.Združeno kraljestvo
- Lawson str. & Spodaj s. (18. maja 2020). Teorija kolizij. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Didaktične značilnosti besedila, struktura, vrste in primeri
- Insular America ali Antillesove države in značilnosti »

