periodična tabela elementov
- 1026
- 80
- Dexter Koch
Kakšna je periodična tabela elementov?
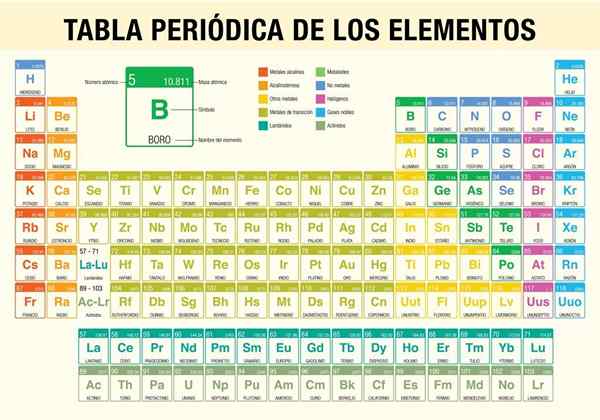
The periodična tabela elementov To je orodje, ki vam omogoča, da se posvetujete s kemičnimi lastnostmi 118 doslej znanih elementov. Pri izvajanju stehiometričnih izračunov je nepogrešljivo, napovedovanje fizikalnih lastnosti elementa, razvrščanje in iskanje občasnih lastnosti med vsemi.
Atomi postanejo težji, saj njihova jedra dodajajo protone in nevtrone, ki jih morajo spremljati tudi novi elektroni; V nasprotnem primeru elektronevtralnost ne bi bila mogoča. Tako so nekateri atomi zelo lahki, kot so vodik, in drugi, superpesados, kot je Oganson.
To je bil znanstvenik Dmitri Mendeléyev, ki je leta 1869 (pred skoraj 150 leti) objavil po desetletju teoretičnih študij in poskusov, prva periodična tabela v poskusu organiziranja 62 elementov, znanih v tistem času.
Za kaj je periodična tabela?
Glavna uporaba tabele so:
- Poznajte simbol in ime vsakega kemičnega elementa, ki obstaja.
- Poznajte atomsko maso in atomsko število elementov.
- Obveščajte o odnosih med različnimi elementi.
- Pokažite različne trende (periodičnost).
- Razvrstitev vrst kemičnih elementov. Te vrste vključujejo alkalne kovine, osnovne kovine, prehodne kovine, ne -kovine, plemenite pline, halogene, alkalne dežele, semimetale, aktinide in lantanide.
- Napovedujte lastnosti novih elementov, ki še niso odkrili ali niso sintetizirani.
Kako je organizirana periodična tabela? (Struktura in organizacija)
Obdobja
Elementi so naročeni v vrsticah ali obdobjih, odvisno od energijske ravni njegovih orbital. Pred obdobjem 4, ko so elementi sledili v naraščajočem vrstnem redu atomske mase, je bilo za vsakih osem od njih kemijske lastnosti ponovno ponovljene (zakon Octave, John Newlands).
Prehodne kovine so se prikradle v druge nemetalne elemente, kot sta žveplo in fosfor. Zaradi tega je bil vnos kvantne fizike in elektronskih konfiguracij za razumevanje sodobnih periodičnih tabel ključnega pomena.
Orbitale energijske plasti so napolnjene z elektroni (in jedri protonov in nevtronov), saj se v obdobju premika. Ta energetska plast gre z roko v roki z atomsko velikostjo ali radiom; Zato so elementi višjih obdobij manjši od tistih, ki jih najdemo spodaj.
H in jaz sem našel v prvi (obdobje) energijski ravni; prva vrsta sivih škatel v četrtem obdobju; in vrsta škatel Ananjadas, v šestem obdobju. Upoštevajte, da čeprav se zdi, da je slednje v domnevnem devetem obdobju, dejansko pripada šesti, tik po rumeni škatli BA.
Skupine
Ogled obdobja je, da se masa, število protonov in elektronov poveča. V istem stolpcu ali skupini, čeprav se masa in protoni razlikujejo, število Elektroni plasti Valencia je enako.
Na primer, v prvem stolpcu ali skupini ima H samo en elektron v orbitalu 1S1, Kot Li (2s1), Natrij (3s1), Kalij (4s1) In tako naprej do Francia (7s1). Ta številka 1 označuje, da imajo ti elementi komaj elektron Valencia in zato spadajo v skupino 1 (AI). Vsak element je v različnih obdobjih.
Brez štetja vodika, zelene škatle, elementi pod njim so iz oranžnih škatel in se imenujejo alkalne kovine. V katerem koli obdobju je še ena na desnem polju, skupina ali stolpec 2; to pomeni, da imajo njegovi elementi dva valenčna elektrona.
Vam lahko služi: teoretična zmogljivostKo pa se premaknete v desno, brez znanja orbital D dosežete skupino Boro (B) ali skupine 13 (IIIA); Namesto skupine 3 (IIIB) ali Scandio (SC). Ob upoštevanju polnjenja orbital d se začnejo prevoziti obdobja sivih škatel: prehodne kovine.
Številke protonov v primerjavi z elektroni Valencije
Pri preučevanju periodične tabele lahko pride do zmede med atomsko številko z ali številom skupnih protonov v jedru in količino valenčnih elektronov. Na primer, ogljik ima z = 6, torej ima šest protonov in zato šest elektronov (sicer ne bi mogel biti atom z nevtralno obremenitvijo).
Toda od teh šestih elektronov, štirje so iz Valencije. Zaradi tega je njegova elektronska konfiguracija [on] 2s22 p2. [On] označuje dva elektrona 1S2 zaprte plasti in teoretično ne sodelujejo pri oblikovanju kemičnih povezav.
Tudi zato, ker ima ogljik štiri valenčne elektrone, se "priročno" nahaja v skupini 14 (DDV) periodične tabele.
Elementi pod ogljikom (da, ge, sn, pb in fl) imajo večje atomske (in atomske) številke; Toda vsi imajo skupne štiri elektrone Valencije. To je ključno za razumevanje, zakaj element pripada eni skupini in ne drugi.
Elementi periodične tabele
Blok s
Kot je razloženo, je za skupine 1 in 2 značilno, da imata v orbitalah en ali dva elektrona. Te orbitale so sferična geometrija, in ker se spustijo katera koli od teh skupin, elementi pridobivajo plasti, ki povečujejo velikost njihovih atomov.
Za predstavo močnih trendov v svojih kemijskih lastnostih in načinih reakcije so ti elementi organizirani kot blok S. Zato v ta blok pripadajo alkalne kovine in alkalne kovine. Elektronska konfiguracija elementov tega bloka je NS (1s, 2s itd.).
Čeprav je element helija na zgornjem desnem koncu tabele, je njegova elektronska konfiguracija 1S2 In zato pripada temu bloku.
Blok str
Za razliko od blokov S, elementi tega bloka predstavljajo popolnoma polne orbitale, medtem ko se njihove p orbitale še naprej polnijo z elektroni. Elektronske konfiguracije elementov, ki pripadajo temu bloku, so tipa NS2Np1-6 (P orbitale imajo lahko napolniti enega ali do šest elektronov).
Torej, v katerem delu periodične tabele je ta blok? Na desni: zelene, stanovanjske in modre škatle; To pomeni, da nemetalni elementi in težke kovine, kot sta bizmut (BI) in svinec (PB).
Začenši z boronom, z elektronsko konfiguracijo NS2Np1, Carbon na vaši desni doda še en elektron: 2s22 p2. Nato so elektronske konfiguracije drugih elementov obdobja 2 bloka P: 2s22 p3 (dušik), 2s22 p4 (kisik), 2s22 p5 (fluorid) in 2s22 p6 (Neon).
Če se spodnja obdobja znižajo, bo imela energija 3: 3s23P1-6, In tako naprej do konca bloka p.
Upoštevajte, da je najpomembnejše v tem bloku ta, da so iz obdobja 4 njegovi elementi popolnoma napolnili orbitale (modre škatle naprej desno). Če povzamemo: blok S je levo od periodične tabele in blok P, na desni.
Reprezentativni elementi
Kateri so reprezentativni elementi? Oni so tisti, ki na eni strani zlahka izgubijo elektrone, na drugi pa jih osvojijo, da dokončajo okto. Z drugimi besedami: to so elementi blokov s in p.
Vam lahko služi: emulzifikator: postopek emulzije, molekularni vidiki, aplikacijeNjihove skupine so se odlikovale od drugih s črko A na koncu. Tako je bilo osem skupin: od ai do viiia. Toda trenutno je oštevilčni sistem, ki se uporablja v sodobnih periodičnih tabelah, arabščina, od 1 do 18, vključno s prehodnimi kovinami.
Zaradi tega je skupina boro lahko IIIA ali 13 (3+10); ogljikova skupina, DDV ali 14; in plemeniti plini, zadnji desno od mize, viiia ali 18.
Prehodne kovine
Prehodne kovine so vsi elementi sivih škatel. V celotnem obdobju so njihove orbitale napolnjene, ki jih je pet in ima zato lahko deset elektronov. Ker mora deset elektronov izpolniti orbitale, potem mora biti deset skupin ali stolpcev.
Vsaka od teh skupin v starem sistemu oštevilčenja je bila določena z rimskimi številkami in črko B na koncu. Prva skupina, ki je bila Scandio, je bila IIIB (3), železo, kobalt in nikelj VIIIB za zelo podobne reaktivnosti (8, 9 in 10) in s cinkom IIB (12).
Kot je razvidno, je veliko lažje prepoznati skupine po arabskih številkah kot z uporabo rimskih številk.
Notranje prehodne kovine
Iz obdobja 6 periodične tabele so orbitale f energijsko na voljo. Te morajo biti napolnjene najprej kot orbitale D; In zato so njegovi elementi običajno nameščeni, da ne bi preveč razširili mize.
Zadnji dve obdobji, oranžna in sivkasta. Obstaja sedem orbital F, ki za zapolnitev potrebuje štirinajst elektronov, zato mora biti štirinajst skupin.
Če bodo te skupine dodane v periodično tabelo, bo skupno 32 (18 + 14) in bo imelo "podolgovato" različico:
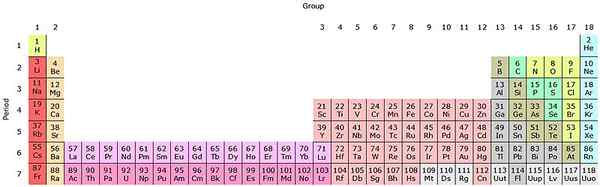 Vir: avtor Sandbh [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons
Vir: avtor Sandbh [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons Čista roza vrstica ustreza lantanoidesom, temno roza vrstica pa aktinoidi. Lantano, z Z = 57, Actinio, AC z Z = 89, in celoten blok F spada v isto skupino Scandio. Ker? Ker ima Scandio orbital1, ki je prisoten v ostalih Lantanoides in aktinoidih.
In AC imata 5D nastavitve Valencia16s2 in 6d17s2. Ko se premikate desno po obeh vrstah, se orbitale 4F in 5F začnejo polniti. Ko ste polni, dosežete elemente Luthacio, Lu in Laurencia, LR.
Kovine in ne -kovine
Če za seboj pustimo torto periodične mize, se je bolj priročno zateči. Trenutno je bila velika večina zgoraj omenjenih elementov kovine.
Pri sobni temperaturi so vse kovine trdne snovi (razen živega srebra, ki je tekočina) srebrno sive (razen bakra in zlata). Običajno so tudi trdi in briljantni; Čeprav so bloki S mehki in krhki. Za te elemente je značilna njihova enostavnost izgube elektronov in oblikovanja kationov m+.
V primeru lantanoidov trije elektroni izgubijo 5D16s2 Postati trivalentni kationi m3+ (kot ona3+). Hrib medtem lahko izgubi štiri elektrone (CE4+).
Po drugi strani pa nemetalni elementi predstavljajo najmanj del periodične tabele. So plini ali trdne snovi s kovalentno povezanimi atomi (na primer žveplo in fosfor). Vsi so nameščeni v bloku P; Natančneje v zgornjem delu tega, ko se spuščajo na spodnja obdobja, poveča kovinski značaj (BI, PB, PO).
Poleg tega jih zmaga ne -metali, namesto da bi izgubili elektrone, zmagajo. Tako tvorijo anione x- Z različnimi negativnimi obremenitvami: -1 za halogene (skupina 17) in -2 za kalkogene (skupina 16, kisik).
Vam lahko služi: etilni alkohol: struktura, lastnosti, uporabe, pridobivanjeKovinske družine
Znotraj kovin je notranja klasifikacija, ki jih lahko razlikuje od:
- Kovine skupine 1 so alkalne.
- Skupina 2, Alkalinerriorne kovine (SR. Scholambara).
- Skupina 3 (IIB) Družina Scandio. To družino sestavljajo Scandio, Group Head, Ititrium in Lantano, Actinio in vse Lantanoides in Actinoides.
- Skupina 4 (IVB), družina Titanium: TI, ZR (Cirkonium), HF (Hafnio) in RF (Rutherfordio). Koliko ima valencia elektroni? Odgovor je v vaši skupini.
- Skupina 5 (VB), družina Vanadio. Skupina 6 (VIB), družina Chrome. In tako naprej do družine cinka, skupina 12 (IIB).
Metaloidi
Kovinski značaj se poveča od desne proti levi in od zgoraj navzdol. Toda kaj je meja med tema dvema vrstama kemičnih elementov? Ta meja je sestavljena iz elementov, znanih kot metaloidi, ki imajo značilnosti tako kovin kot ne -kovine.
Metaloide je mogoče videti v periodični tabeli v "stopnišču", ki se začne z borom, in konča v radioaktivnem elementu Astato. Ti elementi so:
- B: Boro.
- Silicij: Da.
- GE: Germanio.
- Kot: arzen.
- SB: Antimon.
- TE: Telurio.
- AT: Astato.
Vsak od teh sedmih elementov ima vmesne lastnosti, ki se razlikujejo glede na kemično okolje ali temperaturo. Ena od teh lastnosti je polpredsednica, to je, da so metaloidi polprevodniki.
Plini
V kopenskih pogojih so plinasti elementi tiste kovine, ki niso svetlobe, kot so dušik, kisik in fluor. Tudi to klasifikacijo vstopijo klor, vodik in plemeniti plini. Med vsemi so najbolj emblematični plemeniti plini za njihovo nizko nagnjenost k reakciji in obnašanju kot prosti atomi.
Slednje najdemo v skupini 18 periodične tabele in so:
- Helio, on.
- Neon, ne.
- Argon, ar.
- Kripton, Kr.
- Xenón, xe.
- Radón, rn.
- In najnovejši od vseh, plemeniti sintetični ogan plin, OG.
Vsi plemeniti plini imajo skupno konfiguracijo Valencia ns2Np6; to pomeni, da imajo oktet Valencia.
Združevanje držav do drugih temperatur
Elementi so v trdnem, tekočem ali plinastem stanju, odvisno od temperature in trdnosti njihovih interakcij. Če se zemeljska temperatura ohladi, dokler absolutna nič (0k) ni naokoli, bi vsi elementi zamrznili; razen helija, ki bi se zgostil.
Pri tej skrajni temperaturi bi bili preostali plini v obliki ledu.
V drugi skrajnosti, če bi bila temperatura približno 6000k, bi bili "vsi" elementi v plinasti. V teh pogojih so lahko dobesedno opazili oblaki zlata, srebra, svinca in drugih kovin.
Pomen periodične tabele
Trenutno je periodična tabela najpomembnejši organizacijski instrument kemije zaradi podrobnih odnosov njegovih elementov. Njegova uporaba je bistvenega pomena za študente in učitelje, za raziskovalce in številne strokovnjake, namenjene veji kemije in inženiringa.
Če samo pogledamo periodično tabelo, se hitro in učinkovito pridobijo neizmerni znesek in informacije, na primer:
- Litij (li), berilji (be) in boron (b) izvajajo električno energijo.
- Litij je alkalna kovina, berilij je alkalna kovina, boron pa ni kovina.
- Litij je najboljši voznik imenovanih treh, sledi Berlij in končno Boron (polprevodnik).
Tako lahko z iskanjem teh elementov v periodični tabeli njegovo nagnjenost k električni prevodnosti takoj zaključimo.