Kvantna tabela
- 3125
- 403
- Ricky Dach
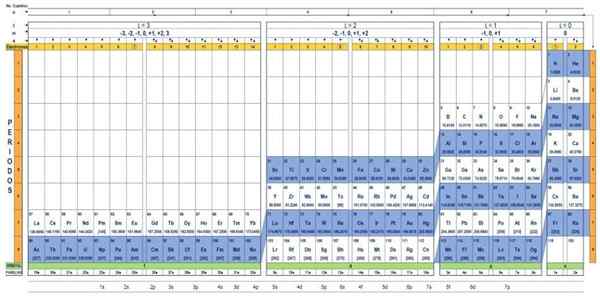
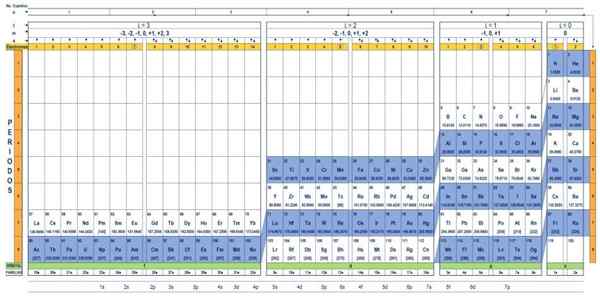 Kvantna tabela elementov. Vir: UNAM.
Kvantna tabela elementov. Vir: UNAM. Kakšna je kvantna tabela?
The Kvantna tabela To je način, kako organizirati kemične elemente, zasnovan za enostavno določitev nabora kvantnih števil, ki so značilni za vsakega od njih.
Znanstveniki so ugotovili, da v naravi vseh elementov obstajajo določeni vzorci. Med temi vzorci so kvantne številke, štiri preproste številke, ki opisujejo elektronsko konfiguracijo vsakega elementa.
Kvantne številke izhajajo naravno iz mehansko-mehanskega modela atoma in jih označujemo s črkami: n, ℓ, mℓ in s. Opisujejo energijsko stanje elektronov v atomu vsakega kemičnega elementa.
Skozi tradicionalno periodično tabelo in nekaj dodatnih orodij je mogoče imeti elektronsko konfiguracijo atoma katerega koli elementa. Prednost kvantne tabele je, da so elementi organizirani tako, da so njihove kvantne številke takoj vidne, brez potrebe po številnih izračunih ločeno.
Značilnosti kvantne tabele
Obstaja več modelov kvantnih tabel. Model, prikazan na zgornji sliki, vsebuje:
- Glava s štirimi vrsticami, z vrednostmi štirih kvantnih številk, n, ℓ, m in s, in peto vrstico v rumeni, kar ustreza številu elektronov v najbolj odmevni orbitali.
- Telo tabele, ki je sestavljeno iz mreže, ki vsebuje simbol kemičnega elementa, ki se začne z vodikom, v predzadnjem stolpcu desne strani, ki mu sledi helij in tako naprej. Spodnja številka predstavlja količino atomskih elektronov v temeljnem stanju.
- Na dnu, v zeleni vrstici so štirje razredi za organiziranje elementov: orbitale s, p, d in f (od leve proti desni).
- Končno je pod orbitalno vrsto družina. Vsak stolpec je družina, oštevilčena od 1 do 32. Na primer, 1. in 2. družine spadata v razred S, družine od 3. do 8a.
Za kaj je kvantna tabela?
Kvantna tabela služi za iskanje niza kvantnih števil, ki označuje elektron iz atoma. Običajno bodo ti elektroni tisti iz najbolj odmevne plasti, saj so tisti, ki opredeljujejo kemijsko vedenje elementa.
Kako je kvantna tabela?
Kvantna tabela omogoča enostavno iskanje kvantnih števila elektronov v najbolj oddaljeni plasti atoma.
Primer 1
Za ponazoritev postopka je primer aluminijasta element kot primer, katerega simbol je za. Prvi korak je, da ga poiščete v kvantni tabeli in ga označite z a Rdeči krog:
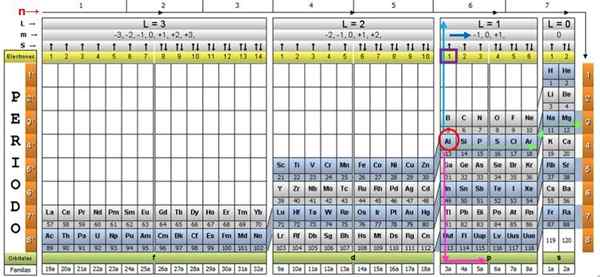
1. korak: poiščite n
Po iskanju elementa v tabeli se morate premikati skozi isto vrstico in barvo, desno, dokler ne pridete do oranžnega stolpca, sledite cesti zelene puščice, prikazane na sliki.
Puščica kaže na označeno polje s številko 3, ki je glavna kvantna številka n:
n = 3
2. korak: Poiščite ℓ
Za določitev sekundarne kvantne številke sledi modra navpična puščica, ki kaže:
ℓ = 1.
3. korak: Poiščite m
Zunanji aluminijasti elektron najdemo v družini Pubilling P, kot je mogoče prebrati v zeleni vrsti.
Poleg tega se količina elektronov v zadnji plasti bere v rumeni vrstici glave. V primeru aluminija je 1 elektron (poudarjen v vijoličnem kvadratu), kar je referenca. Če združimo zgornje rezultate, je konfiguracija zadnje plasti:
Vam lahko služi: galvanska celica: deli, kako deluje, aplikacije, primeri3P1
Znano je, da plast P podpira največ 6 elektronov. In številka M zahteva nekaj celotnih vrednosti - ℓ, ( - ℓ+1),… 0,… (+ℓ −1),+ℓ.
Kot v tem primeru ℓ = 1, potem je m lahko −1, 0, 1.
Te številke se pojavijo v vrstici glave, ki ustreza M (glej na sliki Vodoravna puščica modro). Naslednja tabela služi kot vodnik za vedeti, kakšna je vrednost izbire, odvisno od primera:
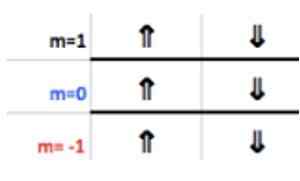
Ker ima zadnji aluminijasti sloj 1 elektron, magnetno kvantno število ustreza
M = 1.
4. korak: Poiščite s
Številka Spin ima samo dve vrednosti: +½ ali - ½. V zgornjem polju, če puščica označuje navzgor, je izbrana s = +½ in če kaže navzdol, potem je s = - ½. V primeru aluminija je elektron 1 poudarja: zato:
S = + ½.
Skratka, kvantna številka elektrona najbolj oddaljene plasti aluminija do zvoka:
n = 3; ℓ = 1; M = 1, s = +½
Primer 2 (izjemni primeri)
Silver Ag in približno še dvajset elementov so izjemni primeri, zato je treba pri uporabi kvantne tabele skrbeti za njih.
Če se prejšnji postopek ponovi, bi Ag dobili kot zadnjo pod -ravni na 4D9.
To je zato, ker je predvidena konfiguracija La Plata po Madelungovem pravilu:
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d9
Vendar v praksi AG ne sledi natančno tej konfiguraciji, niti nobenih drugih elementov, katerih zadnji predvideni sloj je 4D9, na primer baker in zlato, med drugim (posvetujte se z internetom, da pridobite celoten seznam elementov, ki ne sledijo Madelungovemu pravilu).
Vam lahko služi: molealnostPrava konfiguracija AG je:
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s1 4d10
V katerem je elektron 5S plasti2 skočil na 4D plast9 da ga dokončate. Na ta način se stabilnost atoma poveča. Zato je zadnja pod -stopnja res:
5s1
In njene kvantne številke bi bile tiste, ki ustrezajo elementu RB, prikazane v vijoličnem polju, z oranžnimi puščicami, ki kažejo na preostale številke:
n = 5; ℓ = 0; M = 0; S = +½
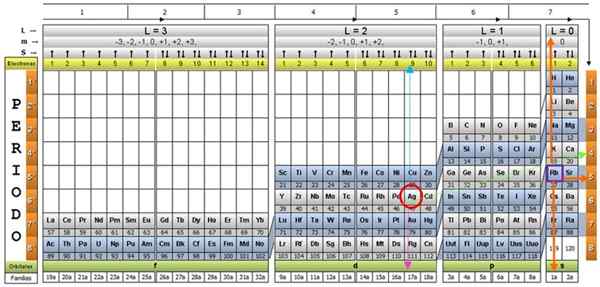 Če pregledate periodično tabelo, dejansko je razvidno, da je Ag v obdobju 5, značilnost, ki jo določa glavno kvantno število n.
Če pregledate periodično tabelo, dejansko je razvidno, da je Ag v obdobju 5, značilnost, ki jo določa glavno kvantno število n.
Razlike s periodično tabelo
Obe tabeli sta dva načina za organiziranje kemijskih elementov glede na značilnosti njihovih atomov:
-V periodični tabeli imajo elementi, ki jih najdemo v istem stolpcu. Na primer, začne se z alkalnim kovinskim stolpcem na levi in konča kot plemenite pline na desni. Medtem ko so v vrstah elementi z enako višjo raven energije.
-Kvantna tabela ima pospešeno razpoloženje, zasnovano v skladu s pravili izpolnjevanja. Zato morate v primeru prejšnjega razdelka slediti korakom, da pridobite glavno kvantno število, razen v primeru izjem, kot je srebro. Družine elementov v tej tabeli so povezane skozi zgornjo orbitalo, v S, P, D ali F.
Reference
- Chang, R. 2013. Kemija. 11VA. Izdaja. McGraw Hill Education.
- Elektronska konfiguracija. Elektronska konfiguracija in kvantne številke. Pridobljeno iz: configuionectronica.com.
- Priročnik za kemijo. Pridobljeno iz: DCB.inženiring.Ne.mx.
- Uradna kemija. Kako enostavno enostavno kvantne številke. Pridobljeno od: uradnika kemije.com
- Triplenlace. Izjeme pri Madelungovem pravilu v elektronski konfiguraciji kemičnih elementov. Pridobljeno iz: Triplenlace.com.

