Čiste snovi

- 1376
- 226
- Ms. Pablo Lebsack
Določimo, kaj so čiste snovi, njihove fizikalne in kemijske lastnosti, kakšne vrste so, in dajemo vam številne primere.
Kaj so čiste snovi?
The čiste snovi so vsi, ki predstavljajo konstantno in lastno kemično sestavo. Se pravi, da so homogeno, Torej jih tvorijo samo atomi ali molekule, ki se pojavljajo v njihovih simbolih ali kemičnih formulah.
Čiste snovi je mogoče razvrstiti po preproste (elementi) ali spojine. So preprosti, ko vsebujejo samo Ena vrsta atoma. So spojine Če imajo Dva ali več različnih atomov tvorijo heterogene molekule.
Primeri preprostih čistih snovi so zlato (AU), baker (Cu) ali cink (Zn). Če najdemo druge različne atome ali elemente, bodo prenehali biti čisti: zlato, pomešano z bakrom ali bakrom, pomešano s cinkom. Zato, mešanice niso čiste snovi.
Primer sestavljene čiste snovi je ogljikov dioksid (CO₂), sestavljen iz dveh atomov kisika in enega ogljika. Lahko ugotovimo, da gre za čisto snov, ker Lahko napišete svojo formulo.
Voda (h₂o) je še en primer sestavljene čiste snovi. Vendar bo prenehalo biti čisto, če dodamo sladkor: mešanica sladkorja in vode je mešanica, ne čista snov. Enako bi veljalo, če bi v njem raztopili soli.
Kalice čistih snovi
Čiste snovi imajo vrsto fizikalnih in kemijskih lastnosti:
Homogenost
So homogeni, zato lahko rečete, da imajo Stalna sestavaE v vsej svoji masi ali razširitvi.
Recimo, da imamo čisto snov, kot je železo (vera). Če ga razdelimo na manjše koščke železa, bo še naprej imel enake fizikalne in kemične lastnosti.
Vam lahko služi: propilen (C3H6)Stalne veličine njegovih lastnosti
Imeti eno samo vrsto atomi ali molekule V čistih snovi so njihove fizikalne ali kemijske lastnosti zelo dobro opredeljene in ne predstavljajo velikih sprememb. To pomeni, da imajo njihove lastnosti stalne velikosti ali vrednosti pri isti temperaturi ali tlaku.
Na primer: čista voda (h₂o) bo vedno kristalna in zavre pri isti temperaturi. Vendar, ko se pomeša z drugimi snovmi, lahko postane oblačno ali spremeni barvo. Potem se začnejo njene lastnosti drugačne: spremenite gostoto, viskoznost, vonj, temperaturo, pri kateri zamrzne ali vre itd.
Različna fizična stanja
Čiste snovi lahko predstavljajo različna stanja ali fizične faze, vzdrževanje njegove sestave in čistosti.
Destilirana voda je čista snov, ki jo tvorijo samo molekule H₂O. Pri zamrzovanju se spremeni v led, vendar se njegova sestava ne spremeni. Enako se zgodi, ko izhlapi: h₂o molekule ostajajo enake.
Voda vzdržuje čistost v treh fizičnih stanjih, razen če je pomešana z drugimi elementi ali spojinami.
Opis po kemični formuli
Čiste snovi je mogoče odlično opisati z Kemična formula.
Na primer, formula H₂o opisuje vodo in njegovo molekulo, tako da lahko čisti rezervoar za vodo opišemo kot H₂o nič več.
Če temu rezervoarju za čisto vodo dodamo sol (NaCl), bomo imeli mešanico, ki je ne moremo več opisati s formulo H₂o in zato ni čista snov.
Kadar snovi (tekočine, trdne ali sode) ni mogoče zlahka opisati z eno kemijsko formulo, potem ni čista.
Vrste čistih snovi
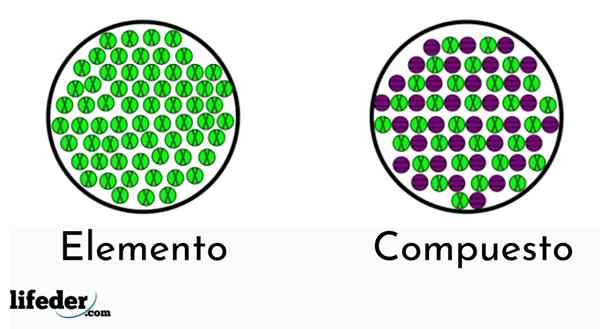 Elementi imajo samo eno vrsto atoma, medtem ko imajo spojine več kot eno vrsto
Elementi imajo samo eno vrsto atoma, medtem ko imajo spojine več kot eno vrsto Obstajata dve vrsti čistih snovi: preproste (kemične elemente) in kemične spojine.
Vam lahko služi: kalcijev karbonat: struktura, lastnosti, tvorba, uporabePreproste snovi (kemični elementi)
Snov, ki jo sestavlja le Vrsta atoma Kemični element lahko šteje za čisto snov. To je tako, da ni zaradi kontaminacije prisotnosti atomov drugega kemičnega elementa ali atomov različnih kemičnih elementov.
Čisto srebro (Ag) tvori samo atomi srebrne kovine (AG). Prav tako se lahko koščke niklja (NI) ali bakra (Cu) štejejo za čiste snovi, če niso prisotne v njihovih delih kontaminacije drugih kemičnih elementov.
Nasprotno, zlitine niso čiste snovi, saj so posledica mešanice dveh ali več kovin. Zato na primer bron ali medenina niso čiste snovi.
Kemične spojine
Čista snov je kemična spojina, če jo sestavlja Dva ali več kemičnih elementov, ki tvorijo heterogene molekule ali niz ionskih omrežij (soli, okside, sulfati itd.).
Primer kemijske spojine je amonijak (NH3), ki jih tvorijo trije vodikovi atomi in dušikovi atom (NH3). Čista snov bo, če so vse njegove molekule iste vrste in imajo NH formulo3. Če pa ga pomešamo z plinastim kisikom ali vodno paro, bo prenehala biti čista snov (to bo plinasta zmes).
Primeri čistih snovi
Preproste čiste snovi
- Magnezij (mg)
- Kalcij (CA)
- Natrij (NA)
- Železo (vera)
- Kositer (sn)
- Plinasti kisik (ali2)
- Helio (on)
- Živo srebro (HG)
- Baker (Cu)
- Nikelj (ni)
Sestavljene čiste snovi
- Ogljikov dioksid (Co₂).
- Ogljikov monoksid (CO).
- Glukoza (c6H12Tudi6.).
- Citrusna kislina (c6H8Tudi7).
- Natrijev sulfat (Na2SW4).
- Natrijev hidroksid (NaOH).
- Voda (h₂o).
- Natrijev karbonat (NA2Co3).
- Žveplova kislina (h2SW4.).
- Natrijev klorid (NACL).
Nasvet za prepoznavanje čiste snovi
Če lahko napišete formulo snovi ali je čisti element, je čista snov.
Teme, ki jih zanimajo
Homogene mešanice
Heterogene mešanice
Reference
- Čelada, Anne Marie, ph.D. Čista definicija snovi. Okreval od: Thoughtco.com
- CK-12 Foundation et al. Čiste snovi in mešanice. Kemija librettexts. Okrevano od: kem.Librettexts.org


