Struktura kalcijevega sulfida (CAS), lastnosti, pridobivanje, uporabe
- 2849
- 832
- Cary Goyette
On Kalcijev sulfid Gre. Je rumenkasto bela topna trdna snov v vodi, ki jo v naravi najdemo v nekaterih vulkanih in v nekaterih meteoritih v obliki minerala, imenovanega Oldhamit.
CAS pri raztapljanju v vodi tvori različne spojine, ker žveplovi ion S2- postane ion sh- in OH so oblikovani-. Nastala rešitev je alkalna. Ta spojina se uporablja kot osnova za luminiscentne spojine ali ki pod določenimi pogoji proizvaja vidno svetlobo. Ti materiali se uporabljajo tudi v svetlobnih slikah.
 CAS kalcijev sulfid je bil najden v nekaterih meteorijih. Avtor: ROTE жravёvv. Vir: Pixabay.
CAS kalcijev sulfid je bil najden v nekaterih meteorijih. Avtor: ROTE жravёvv. Vir: Pixabay. CAS je veljal za možno zdravilo za zdravljenje srčnih težav in krvnih žil, kot sta hipertenzija ali visok tlak, kar je bolezen, ki prizadene velik del svetovne populacije.
S kalcijevim sulfidom lahko dobimo druge spojine, kot sta kalcijev nitrat in kalcijev karbonat. Ravnati z njim previdno in v stiku z vlago atmosfere lahko ustvari h2S, ki je zelo strupen.
[TOC]
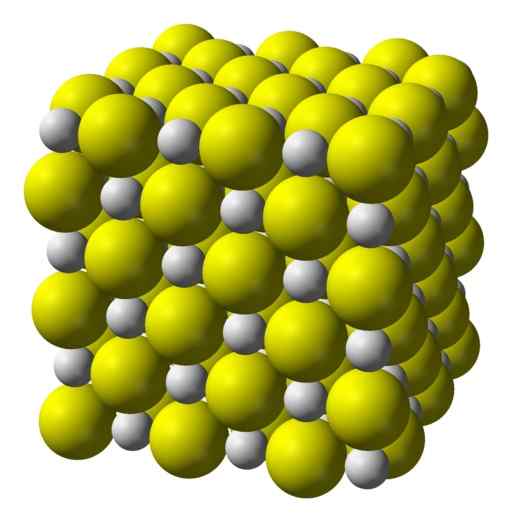
Struktura
Kalcijev sulfid je zelo ionska spojina, ki jo tvori kalcijev ion CA2+ in sulfidni ion S2-.
Kristalizirajte v kubični strukturi, kot je kamnita sol.
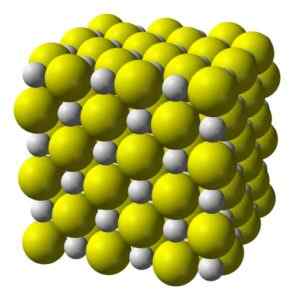 Kubična kristalna struktura kalcijevega sulfida. Rumena = žveplo; Bela = kalcij. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons.
Kubična kristalna struktura kalcijevega sulfida. Rumena = žveplo; Bela = kalcij. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons. Nomenklatura
- Kalcijev sulfid
Fizične lastnosti
Fizično stanje
Rumenkasto bela kristalna trdna, kubična kristala, kot je natrijev klorid.
Molekularna teža
72,144 g/mol
Tališče
2528 ° C
Gostota
2,59 g/cm3
Topnost
Topno v vodi. Netopna v etanolu.
Kemične lastnosti
Vodna raztopina
Pri raztapljanju v vodi se CAS loči na njegove ione kalcija 2+ in sulfid s2-. Slednji v vodi vzame proton in postane hidrosulfuro ion Shh- Sprostitev oh hidroksilnega iona-.
Vam lahko služi: presedenoS2- + H2Ali ⇔ sh- + Oh-
Zato so raztopine kalcijevega sulfida alkalne (imajo osnovni pH) in nimajo ionov2- ampak sh-.
Šele v primeru, da se raztopini doda velika količina alkalij2-.
 Kalcijev sulfid se raztopi v vodi, ki tvori druge spojine. Avtor: Clker-brez vektorjev. Vir: Pixabay.
Kalcijev sulfid se raztopi v vodi, ki tvori druge spojine. Avtor: Clker-brez vektorjev. Vir: Pixabay. Sh- Lahko vzamete še en proton h+ vode, ki tvori vodikov sulfid, ki je zelo strupena spojina.
Sh- + H2Ali ⇔ h2S + OH-
Zato majhne količine oblike H v vodi2S in s izpostavljenostjo vlažnosti okolja CAS oddaja neprijeten vonj, značilen za vodikov sulfid.
Spojine prisotne pri raztapljanju v vodi
Rezultat predhodno navedenih reakcij vode je, da nastane Ca (SH)2, CA (OH)2 in ca (sh) (oh).
Cas + h2O → CA (SH) (OH)
Ca (sh) (oh) + h2O → CA (OH)2 + H2S
Kislinska reakcija
Zaradi istih reakcij, ki se pojavijo v vodi, reagirajo s kislinami h2S.
Cas + 2 HCl → CACL2 + H2S
Druge reakcije
Če se segreva raztopina kalcijevega sulfida z žveplom, dobimo polisulfidni ioni42- in s32-.
Če se CAS segreje v suhem zraku ali čisti kisik, se spojina oksidira v ohišje kalcijevega sulfita3 In nato do primera kalcijevega sulfata4:
2 Cas + 3 o2 → 2 primer3
2 primer3 + Tudi2 → 2 primer4
Z oksidacijskimi sredstvi, kot je KClo kalijev klorat3, Kno kalijev nitrat3 ali svinčeno dioksid2 pojavijo nasilne reakcije.
Pridobivanje
Kalcijev sulfid lahko pripravimo tako.
Lahko vam služi: kloro kislina (HClo2)Ca + S + toplota → CAS
Lahko dobimo tudi s segrevanjem primera kalcijevega sulfata4 S premog:
Ovitek4 + 2 C → CAS + 2 CO2
Vendar v slednjem primeru čiste hiše ne dobimo, saj z primerom reagira tudi4 Oblikovanje Cao in tako2.
CAS nastane tudi s kurjenjem odpadkov za premog.
Prisotnost v naravi
CAS je naravno prisoten v mineralu Oldhamita. To je sestavni del nekaterih meteoritov in je pomembna z znanstvenimi raziskavami, ki se izvajajo na sončnem sistemu.
Verjame se, da je bila Oldhamita oblikovana s kondenzacijo v meglici, ki je nastala. Prisoten je tudi v vulkanih.
 CAS kalcijev sulfid je v mineralu Oldhamita, ki so ga našli v nekaterih meteorijih. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
CAS kalcijev sulfid je v mineralu Oldhamita, ki so ga našli v nekaterih meteorijih. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Poleg tega se kalcijev sulfid naravno proizvaja z zmanjšanjem primera4 (omet) po možnosti z delovanjem bakterij.
Prijave
V lahkih materialih
Ena najbolj razširjenih uporabe kalcijevega sulfida je bila osnova za svetlobne spojine. To so snovi, ki v določenih okoliščinah oddajajo vidno svetlobo.
V luminescentnih spojinah CAS to deluje kot baza in aktivatorji se dodajo strukturi, kot so kloridi nekaterih elementov, kot je Cerio (CE3+) in Europio (EU2+).
Material, ki je posledica CAS Unije in aktivatorja, se uporablja na primer na zaslonih katodnih žarkov, ki sestavljajo stare zaslone računalnikov ali računalnikov ali starih televizijskih naprav.
 Starodavni monitorji računalnikov so imeli katodne cevi za žarke, v katerih včasih uporabljajo luminiscentne spojine kalcijevega sulfida in aktivatorjev včasih. Avtor: Andreas160578. Vir: Pixabay.
Starodavni monitorji računalnikov so imeli katodne cevi za žarke, v katerih včasih uporabljajo luminiscentne spojine kalcijevega sulfida in aktivatorjev včasih. Avtor: Andreas160578. Vir: Pixabay. Uporabljajo se tudi v trenutnih svetilkah svetlobnih diod ali LED (kratica za angleščino Lahke diode).
Vam lahko služi: ayaroína LED svetilka. Nekateri lahko vsebujejo luminescentne spojine kalcijevega sulfida. Noben strojno berljiv avtor ni zagotovil. Apper je domneval (na podlagi zahtevkov za avtorske pravice). /Cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/). Vir: Wikimedia Commons.
LED svetilka. Nekateri lahko vsebujejo luminescentne spojine kalcijevega sulfida. Noben strojno berljiv avtor ni zagotovil. Apper je domneval (na podlagi zahtevkov za avtorske pravice). /Cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/). Vir: Wikimedia Commons. Ti materiali se uporabljajo tudi v lahkih slikah in laki.
V medicini
Kalcijev sulfid je bil v medicinskih študijah obravnavan kot zdravilo za zdravljenje arterijske hipertenzije (visok tlak v arterijah). To je bolezen, ki vpliva na kardiovaskularni sistem mnogih ljudi (srce in krvne žile).
CAS velja za "darovalca" H2S. To ima pomembno vlogo pri uravnavanju tonusa ali jakosti krvnih žil, zato bi lahko bila dajanje CAS možno zdravilo za zdravljenje hipertenzije.
 Kalcijev sulfid je bil proučen kot možno zdravilo za visok pritisk srčno -žilnega sistema bolnih ljudi. Avtor: Mohamed Hassan. Vir: Pixabay.
Kalcijev sulfid je bil proučen kot možno zdravilo za visok pritisk srčno -žilnega sistema bolnih ljudi. Avtor: Mohamed Hassan. Vir: Pixabay. Pri pridobivanju drugih spojin
Kalcijev sulfid omogoča pripravo drugih spojin, kot je kalcijev nitrat CA (št3)2:
Cas + 2 hno3 → CA (št3)2 + H2S
Uporablja se tudi za pridobivanje caco kalcijevega karbonata3. Za to se v premog predloži vodna raztopina CAS2:
Cas + h2Ali + co2 → H2S + caco3
Druge aplikacije
Kalcijev sulfid se uporablja tudi kot dodatek za maziva in kot flotacijsko sredstvo pri ekstrakciji mineralov.
Tveganja
Kalcijev sulfid lahko povzroči draženje kože, oči in dihalnega trakta. Je treba manipulirati s previdnostnimi in ustreznimi varnostnimi pripomočki.
To je zelo strupena spojina za vodno življenje, zato je nevarna za ta okolja.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Svinec, d.R. (urednik). (2005). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Ropp, r.C. (2013). Skupina 16 (O, S, SE, TE) Alkalne zemeljske spojine. Kalcij sulfida. V enciklopediji alkalnih zemeljskih spojin. Okrevano od Scientirect.com.
- Li, in.F. et al. (2009). Kalcijev sulfid (CAS), do darovalca vodikovega sulfida (H (2) s): nov antihipertenziven Drarug? MED HUPHOTHES, 2009 SEP; 73 (3): 445–7. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Hiša j.In. in hiša, k.Do. (2016). Žveplo, selen in tellurij. Se pojavijo v žveplom. V opisni anorganski kemiji (tretja izdaja). Okrevano od Scientirect.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Kalcijev sulfid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Pivo, m. et al. (2014). Pretvorba kalcijevega sulfida v kalcijev karbonat med postopkom predelave elementarnega žvepla iz mavčnih odpadkov. Upravljanje odpadkov, 2014 november; 34 (11): 2373–81. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- « Kvantitativne raziskovalne značilnosti, tehnike, primeri
- Lastnosti kalcijevega silikata, struktura, pridobivanje, uporabe »

