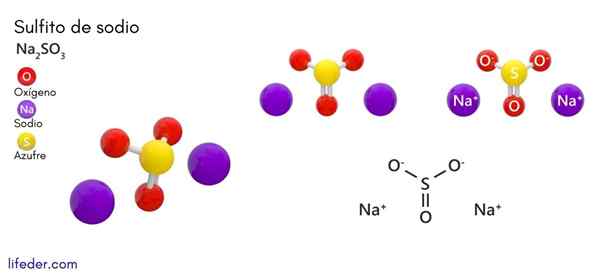
Natrijev sulfit (NA2SO3)
- 3291
- 664
- Percy Feeney
Kaj je natrijev sulfit?
On natrijev sulfit ali natrijev sulfit, katerega kemijska formula je na2SW3, To je topna natrijeva sol, ki jo dobimo kot produkt reakcije žveplove kisline (ali žveplovega oksida (IV)) z natrijevim hidroksidom.
Med letoma 1650 in 1660 je Glauber začel izdelovati natrijev sulfit iz skupne soli (NACL) in koncentrirane žveplove kisline. Ta postopek velja za začetek kemične industrije.
Proces sulfita proizvaja leseno kašo, ki jo opazimo kot skoraj čisto celulozno vlakno z več žveplovimi kislimi soli za ekstrahiranje lignina lesenih cepic.
Tako imajo sulfiti veliko številnih aplikacij različnih vrst, tudi v prehrambeni industriji kot aditiv. Med svojimi najpomembnejšimi funkcijami je njeno encimsko in ne -encimsko rjavljivost, nadzor in inhibicija mikrobne rasti, preprečevanje oksidativnega ukoreninjenja in spreminjanje reoloških lastnosti hrane.
Priprava natrijevega sulfita
Na splošno se v laboratorijski meri natrijevi sulfit pojavi iz reakcije raztopine natrijevega hidroksida z žveplovim dioksidnim plinom (2naOH + SO2 → NA2SW3 + H2Da).
Potem evolucija SO2 Z dodajanjem nekaj kapljic koncentrirane klorovodikove kisline bo nakazovalo, če natrijev hidroksid skoraj manjka, pretvorjen v vodni natrijev sulfit (NA2SW3 + 2HCl → 2nacl + SO2 + H2Da).
Po drugi strani pa to kemično spojino dobimo industrijsko z reakcijo sulfid dioksida z raztopino natrijevega karbonata.
Vam lahko služi: spektralni zapisZačetna kombinacija ustvarja natrijev bisulfit (Nahso3), Da se z reakcijo z natrijevim hidroksidom ali natrijevim karoksidom pretvori v natrijev sulfit. Te reakcije je mogoče povzeti v globalni reakciji2 + Na2Co3 → NA2SW3 + Co2.
Kemična struktura
Za vse oblike natrijevega sulfita so značilne, da so bele, kristalne in higroskopske trdne snovi, ki imajo sposobnost enostavno privabljanja in zadrževanja molekul vode okoliškega okolja, ki so običajno pri sobni sobni temperaturi.
Vrsta kristalne strukture je povezana s prisotnostjo vode v spojini. Anhidridni natrijev sulfit predstavlja ortrombično ali šesterokotno strukturo in, če obstaja prisotnost molekul vode v spojini, spremeni njegovo strukturo (na primer heptahidrat natrijev sulfit predstavlja monoklinično strukturo).
Lastnosti
Ta vrsta ima določene fizikalne in kemijske lastnosti, ki jo razlikujejo od drugih soli, ki so opisane spodaj:
Kemične lastnosti
Kot nasičena vodna raztopina ima ta snov približno pH 9. Poleg tega rešitve, izpostavljene zraku, sčasoma oksidirajo natrijev sulfat.
Po drugi strani pa, če se natrijev sulfit vodne raztopine pusti, da kristalizira pri sobni temperaturi ali nižji, to naredi kot heptidrat. Heptahidrati kristali izliva v vročem in suhem zraku, v zraku pa tudi oksidirajo, da tvorijo sulfat.
V tem smislu je oblika anhidra veliko bolj stabilna proti oksidaciji zraka. Sulfit je nezdružljiv s kislinami, močnimi oksidanti in visokimi temperaturami. Je tudi netopna v amonijaku in kloru.
Vam lahko služi: izopropil alkoholFizične lastnosti
Anhidridni natrijev sulfit ima molarno maso 126,43 g/mol, gostoto 2.633 g/cm3, Fuzijska točka 33,4 ° C (92,1 ° F ali 306,5 K), vrelišča 1.429 ° C (2,604 ° F ali 1.702 K). Prav tako je topnost (merjena pri temperaturi 20 ° C) 13,9 g/100 ml.
Uporaba/aplikacije
Natrijev sulfit je zaradi svojih reaktivnih lastnosti zelo vsestranski in trenutno uporablja široko vrste panog.
- Široko se uporablja pri čiščenju vode in izločanju raztopljenega kisika v vodnih kotlih.
- Ima tudi aplikacije v papirni industriji (polkid celuloze).
- Pri fotografiji se uporablja pri izdelavi razkrivanja.
- V ustrezni meri se uporablja pri ohranjanju hrane in antioksidantov.
- V tekstilni industriji se uporablja v procesih pranja in antikloro.
- Uporablja se tudi kot reducirsko sredstvo.
- Poleg tega se uporablja pri sekundarnem predelavi oljnih vrtin.
- Uporablja se celo pri izdelavi organskih spojin, barvil, črnil, viskoznih rajona in gumic.
- Uporablja se pri izdelavi številnih kemikalij, vključno s kalijevim sulfatom, natrijevim sulfitom, natrijevim silikatom, natrijevim hiposulfitom in natrijevim aluminijem sulfatom.
Tveganja
Učinki na izpostavljenost spojini
Dolgotrajna ali večkratna izpostavljenost tej snovi lahko povzroči dermatitis in reakcije občutljivosti. Izpostavljenost v sulfitu, občutljivih, astmatičnih in atopičnih.
Podobno lahko kislina razgradnja natrijevega sulfita sprosti strupen in nevaren dim žveplovih oksidov, vključno z žveplovim dioksidom, ki lahko povzroči trajno pljučno poslabšanje zaradi kronične in akutne izpostavljenosti.
Vam lahko služi: ididio 192Podobno je akutna zastrupitev z žveplovim dioksidom redka, ker se plin zlahka odkrije. Tako draži, da stika ni mogoče dopuščati.
Med simptomi so vključeni kašelj, govorice, kihanje, trganje in dihanje. Vendar pa lahko zaposleni z visoko neizogibno izpostavljenostjo utrpijo pomembno in morda smrtno škodo na pljučih.
Ekotoksičnost
Natrijev sulfit je ne -hrepeneča rešitev, ki se običajno uporablja kot preostalo sredstvo za upad vode. Visoke koncentracije prispevajo k velikemu povpraševanju po kemičnem kisiku v vodnem okolju.
Poraba hrane s konzervansi
Eden od dodatkov, ki lahko pri občutljivih ljudeh povzroči težave, je skupina, znana kot sulfitacijska sredstva, ki vključujejo več sulfitnih anorganskih dodatkov (E220-228), vključno z natrijevim sulfitom (tako2).
Pri preobčutljivih ali astmatičnih ljudeh, uživanju živil s sulfiti ali vdihavanjem žveplovega dioksida je lahko strupena.
Te spojine so odgovorne za Bronch-Contraint, ki pomeni težave pri dihanju. Edino zdravljenje te prekomerne reakcije je izogibanje hrani in pijačah, ki vsebujejo sulfite.