Struktura, lastnosti, lastnosti, pridobivanje, uporaba, uporaba, uporaba

- 946
- 25
- Raymond Moen
On Mangan sulfat (ii) Gre za anorgansko trdno snov, ki jo tvorijo manganovi elementi (MN), žveplo (S) in kisik (O). Njegova kemična formula je MSO4. Njegova brezvodna oblika (brez vode v strukturi) je bela trdna snov. Vendar ima več hidriranih oblik in vse so roza trdne snovi.
Mangan sulfat v zelo majhnih (drobnih) količinah se uporablja kot mikrohranil tako za živali kot za ljudi, saj je potrebno za normalno delovanje organizma.
 Mangan sulfat anhidro mnso4. YOSF0113 na angleški Wikipediji / javni domeni. Vir: Wikimedia Commons.
Mangan sulfat anhidro mnso4. YOSF0113 na angleški Wikipediji / javni domeni. Vir: Wikimedia Commons. Dodamo ga tudi skupaj z določenimi gnojili na pomanjkljivih tleh v manganu (MN) za kmetijske pridelke, ki ga potrebujejo, kot so grozdne rastline.
Zaradi roza obarvanosti hidriranih sort se uporablja pri pigmentih, ki služijo za barvanje keramike, barvanje tkanin in drugih materialov. Služi tudi za pridobivanje drugih manganovih spojin.
Mons4 je treba skrbno manipulirati. Njegovo vdihavanje lahko povzroči težave z dihanjem in povzroči resne nevšečnosti v živčnem sistemu, ki vključujejo simptome, podobne Parkinsonovi bolezni.
Njegov presežek lahko povzroči škodo na kopnih in vodnih živalih in rastlinah.
[TOC]
Struktura
Brezvodni manganski sulfat (brez vode v svoji kristalni strukturi) tvori manganov ion v oksidaciji +2, torej Mn2+ in sulfatni anion tako42-.
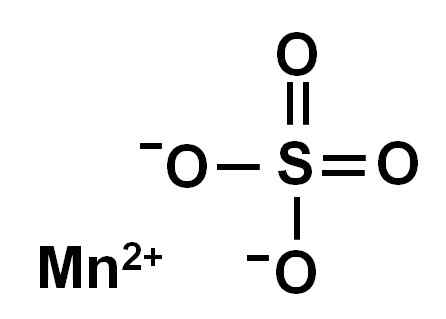 Kemična struktura mangana sulfata4. Avtor: Marilú Stea.
Kemična struktura mangana sulfata4. Avtor: Marilú Stea. Nomenklatura
- Mangan sulfat (ii)
- Mangan monosulfat
- Mangan sulfat anhidro mnso4
- Mangan mangan sulfat msso4 •H2Tudi
- Tetrahidrat manganov sulfat MSO4 •4H2Tudi
- Manganski sulfat pentahidrat4 •5H2Tudi
- Heptidrirani manganski sulfat4 •7H2Tudi
Lastnosti
Fizično stanje
Mons4 brezvodna (brez vode v svoji strukturi) je kristalna bela trdna snov. Vendar so hidrirane sorte roza ali bledo rdeče trdne snovi.
 Manganaso sulfat tetrahidrat mnso4.4H2Ali je roza trdna. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons.
Manganaso sulfat tetrahidrat mnso4.4H2Ali je roza trdna. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons. Molekularna teža
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Tališče
Brezvodni MSSO4 = 700 ° C
Monohidrat MSO4 •H2O = 400-450 ° C
Menso tetrahidrat4 •4H2O = 30 ° C
Vrelišče
Brezvodni MSSO4 = Razpade pri 850 ° C.
Lahko vam služi: kobalt klorid (COCL2 (: struktura, nomenklatura, lastnostiMenso tetrahidrat4 •4H2O = 850 ° C
Gostota
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Topnost
Zelo topno v vodi: 52 g/100 ml vode pri 5 ° C. Alkohol topen. Netopna v etru. Rahlo topen v metanolu.
ph
Rešitev Monse4 •H2Ali 5% ima pH 3,7.
Kemične lastnosti
Pri raztapljanju v vodi se MNSO4 loči na njegove MN ione2+ In tako42-.
Manganski ion (ii) mn2+ V kisli ali nevtralni raztopini je povezan s 6 molekulami vode2Ali oblikovanje heksaacuomanganskega iona [Mn (h2Da)6]2+, ki je roza.
Hexaacuomanganski ion [Mn (h2Da)6]2+ Je precej odporen na oksidacijo. V osnovnem mediju (alkalni pH) ta ion postane manganov hidroksid (ii) MN (OH)2, ki je zlahka oksidirano, tvori manganove spojine (III) in mangana (IV).
 MSSO rešitve4 Kisline so rožnate s prisotnostjo heksaakuomanganskega iona [Mn (H2Da)6]2+. Avtor: Steve Cross. Vir: Pixabay.Mangan sulfat ima več hidriranih oblik, torej z vodo h2Ali v svoji kristalni strukturi.
MSSO rešitve4 Kisline so rožnate s prisotnostjo heksaakuomanganskega iona [Mn (H2Da)6]2+. Avtor: Steve Cross. Vir: Pixabay.Mangan sulfat ima več hidriranih oblik, torej z vodo h2Ali v svoji kristalni strukturi.
To so monohidratni mSO4 •H2Ali, tetrahidrat MSO4 •4H2Ali, mnse pentahidrat4 •5H2O in heptidrat MSO4 •7H2Tudi. Te hidrirane oblike vsebujejo heksaakuomanganski ion [Mn (H2Da)6]2+ V svojih kristalih in zaradi tega so roza trdne snovi.
Monohidrat Menso4 •H2Ali pa je rahlo odtok, kar pomeni, da počasi izgubi nekaj hidracijske vode, ko je izpostavljena okolju.
Pridobivanje
Mons4 lahko dobimo z zdravljenjem manganovega oksida (II) MNO, MN manganskega hidroksida (OH)2 o manganski karbonat (ii) mnco3 Z žveplovo kislino h2SW4.
Mnco3 + H2SW4 → MSSO4 + H2Ali + co2
Prijave
Kot prehransko dopolnilo
Mangan sulfat v drobnih količinah služi določenim funkcijam človeškega telesa in živali.
Zato je pomemben kot koristna spojina pri prehrani in je dobavljena kot prehrambeni dodatek. Uporablja se v sledovih (izjemno majhne količine).
Velike količine so lahko zelo strupene in škodljive.
V veterinarski medicini
Mons4 Koralne ptice (piščance, purane, race in faisani) se dajejo za preprečevanje pomanjkanja ali pomanjkanja manganovega elementa pri teh živalih.
Vam lahko postreže: kalijev jodate (kio3)Manganovo pomanjkanje se v njih kaže na primer kot bolezen, imenovana peroza, ki je deformacija kosti mladih ptičjih nog.
 Patitos lahko zahtevajo pošastne sledi4 V svoji prehrani za preprečevanje peroze. Avtorji: s. Hermann & F. Richter. Vir: Pixabay.
Patitos lahko zahtevajo pošastne sledi4 V svoji prehrani za preprečevanje peroze. Avtorji: s. Hermann & F. Richter. Vir: Pixabay. Velja za hranjenje teh ptic v zelo majhnih količinah ali sledeh.
V kmetijstvu
Manganov sulfat se uporablja kot mikrohranil pri gnojilih za trto (grozdne rastline) in nasade tobaka v pomanjkljivih lestvicah v manganu.
Vendar nekatere študije kažejo, da lahko presežek manganov sulfat zavira ali zmanjša nastanek nekaterih pomembnih encimov za rast rastlin in njihove izbruhe.
 V nekaterih primerih uporablja mnso4 do tal, kjer so grozdne rastline. Avtor: Schwoaze. Vir: Pixabay.
V nekaterih primerih uporablja mnso4 do tal, kjer so grozdne rastline. Avtor: Schwoaze. Vir: Pixabay. Na primer, ugotovili so, da je strupena za nekatere pridelke, kot je bombaž.
Mons4 Uporablja se tudi pri fungicidih in skupaj z določenimi organskimi spojinami je del nekaterih pesticidov.
V več aplikacijah
Mons4 Hidrirano uporablja njegovo obarvanost za pripravo anorganskih pigmentov, ki se uporabljajo v rdečih lastih za keramiko, v tkaninah in drugih materialih.
Mangan sulfat se uporablja v proizvodnji stekla in z njim so pripravljeni tudi mila.
 Nekatere keramične ploščice lahko vsebujejo manganske sulfatne pigmente. Avtor: DWilliams. Vir: Pixabay.
Nekatere keramične ploščice lahko vsebujejo manganske sulfatne pigmente. Avtor: DWilliams. Vir: Pixabay. Mons4 Izhodiščni material je, da pridobimo elektrolično kovino manganovo kovino (MN), to je z uporabo električne energije v vodnih raztopinah.
Omogoča tudi pridobivanje manganovega dioksida2 in manganov karbonat3.
Mons4 Uporablja se tudi za kemijsko analizo in pri oblikovanju raztopin, ki se uporabljajo v genetskih poskusih z mikroorganizmi.
Tveganja
Mangan sulfat vsebuje manganov ion (ii) (MN2+), ki so lahko tako neškodljive kot strupene, odvisno od količine, za katere je izpostavljena oseba, žival ali rastlina.
Mangan je bistvenega pomena za normalno delovanje organizma ljudi, živali in nekaterih rastlin. Toda na žalost je mangan tudi nevrotoksičen, to je, da vpliva na živčni sistem in nekatere rastlinske funkcije.
Vam lahko služi: Kdo je zasnoval prvi sodobni termometer?Na videz varne zneske
Mons4 Upravna s hrano in zdravili ali FDA (kratica za angleščino, ki jo uporablja hrana v obliki hrane (izjemno majhne ali drobne količine), je na splošno varna Uprava za hrano in zdravila).
Nevarni zneski
Dolgotrajna ali večkratna izpostavljenost tej spojini v pomembnih količinah lahko škodi človeku in živalim.
Draževanje v sluznici in sluznici dihalnih traktov, anoreksije, glavobola, izgube ravnotežja, pljučnice in dihalnih okužb.
Kronično vdihavanje povzroči poškodbe živčnega sistema, ustvarja mangalizem, tremor v značilnih rokah in simptomi Parkinsonove bolezni.
 Mangan sulfat vpliva na živčni sistem. Avtorica: Sabine Zierer. Vir: Pixabay.
Mangan sulfat vpliva na živčni sistem. Avtorica: Sabine Zierer. Vir: Pixabay. Zato se je treba izogibati disperziji MSO prahu4, Uporabite dihalno opremo in zaščitne rokavice.
Je strupen za vodno življenje in v tem ustvarja dolgoročne učinke. Shranjen mora biti na mestih, kjer ni dostopa do odtočnega ali kanalizacijskega sistema. Zelo pomembno je, da ne dovolite, da bi ga v okolju zavrgli.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Sulfat Mangan. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A22. VCH Verlagsgellschaft MBH.
- Ali.S. Nacionalna knjižnica medicine. (2019). Mangan sulfat monohidrat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Dunham, m.J. (2010). Vodnik po genetiki Yast: funkcionalna genomika, proteomika in druge analize sistemov. Srednja formulacija. V metodah v encimologiji. Okrevano od Scientirect.com.
- Saric, m. in Lucchini, r. (2007). Mangan. Uporabljaš. V priročniku o toksikologiji kovin (tretja izdaja). Okrevano od Scientirect.com.
- Vallero, d. (2014). Nevrološki učinki zračnih polutantov. Mangan. V sredstvih onesnaževanja zraka (peta izdaja). Okrevano od Scientirect.com.
- Chee, r. (1986). In vitro Kultura Vitis: Učinki svetlobnega spektra mangana sulfata in kalijevega jodida na morfogenezo. Cult rastlinskih celic, tiskov in organov 7: 121-134 (1986). Povezava je bila obnovljena.Springer.com.
- « Struktura Secbutila, značilnosti, nomenklatura, usposabljanje
- +125 kratke in priljubljene izreke [s pomenom] »

