Estri
- 875
- 190
- Percy Feeney
 Esteres so organske spojine, ki imajo sestavni del karboksilne kisline in še en alkohol
Esteres so organske spojine, ki imajo sestavni del karboksilne kisline in še en alkohol Kaj so estri?
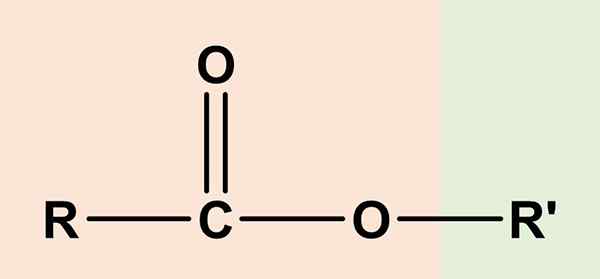
The estri So organske spojine, ki imajo komponento karboksilne kisline in še en alkohol. Njegova splošna kemična formula je RCO2R' ali rcoor'. Desna stran, RCOO, ustreza karboksilni skupini, desno, ali' Je alkohol. Oba si delita atom kisika in imata določeno podobnost z etrima (ROR ').
Zaradi tega acetat etila, ch3Cooch2Pogl3, Najpreprostejši ester, veljal za Eter ocetnega ali kisle kisline, In od tam etimološki izvor imena 'ester'. Tako da je ester sestavljen iz zamenjave kislega vodika skupine COOH z najemnino alkohola iz alkohola.
Kje so estri?
Iz tal organske kemije je veliko naravnih virov. Prijeten vonj sadja, kot so banane, hruške in jabolka, je produkt interakcije estrov z mnogimi drugimi sestavnimi deli. Najdemo tudi v obliki trigliceridov v oljih ali maščobah.
Naše telo proizvaja trigliceride iz maščobnih kislin, ki imajo dolge gazirane verige, in glicerolski alkohol. Kar razlikuje nekatere estre od drugih, je tako v R, verigi kisle komponente, kot v R ', komponenta alkoholne komponente.
Ester z nizko molekulsko maso mora imeti malo ogljikov v R in R ', medtem ko imajo drugi, kot so voski, veliko ogljikov, zlasti v R', alkoholni komponenti in zato visoke molekulske mase.
Vendar niso vsi estri strogo organski. Če atom skupine Carbonhel iz karbonilne skupine nadomesti eden od fosforja, potem bo RPOOR imel '. To je znano kot fosfatni ester in je ključnega pomena pri strukturi DNK.
Tako lahko, kadar je atom učinkovito povezan z ogljikom ali kisikom, na primer žveplo (rsoor '), lahko posledično tvori anorganski ester.
Lastnosti estres
Estri niso kisline ali alkoholi, zato se ne obnašajo kot take. Njegove točke taljenja in vrelišča so na primer nižje od tistih s podobno molekulsko maso, vendar bližje vrednostim aldehidi in ketoni.
Butanojska kislina, cho3Pogl2Pogl2COOH, ima vrelišče 164 ° C, medtem ko etil acetat, ch3Cooch2Pogl3, od 77.1. c.
Poleg nedavnega primera so vrelišča 2-metilbutana3Ch (pogl3) Pogl2Pogl3, Metil acetat, cho3Cooch3, in 2-butanol, cho3,Ch (oh) ch2Pogl3, So takšni: 28, 57 in 99 ° C. Tri spojine imajo molekulske mase 72 in 74 g/mol.
Estri z nizko molekularno pesos so ponavadi nestanovitni in imajo prijetne vonjave, zato jim vsebina v sadju daje njihove družinske dišave. Po drugi strani, ko so molekulske mase visoke, so brezbarvne in brez vonja kristalne trdne snovi ali odvisno od njihove strukture, lahko kažejo maščobne lastnosti.
Topnost vode
Karboksilne kisline in alkoholi so običajno topne v vodi, razen če imajo visok hidrofobni značaj v svojih molekularnih strukturah. Enako velja za estre. Kadar so R ali R 'kratke verige, lahko ester komunicira z molekulami vode skozi dipol-dipolo in sili londonskih sil.
Vam lahko služi: kemična spojinaTo je zato, ker so estri sprejemniki vodikovega mostu. Kot? Za dva atoma kisika RCOOR '. Molekule vode lahko tvorijo vodikove mostove s katerim koli od teh kisika. Ko pa so verige R ali R zelo dolge, odbijajo vodo v okolici, zaradi česar onemogočajo njihovo raztapljanje.
Očiten primer tega se zgodi s trigliceridnimi estri. Njihove stranske verige so dolge in naredijo olja in maščobe netopna v vodi, razen če so v stiku z manj polarnim topilom, bolj povezani s temi verigami.
Reakcija hidrolize
Esteres lahko reagirajo tudi z molekulami vode v tako, kot je znano kot reakcija hidrolize. Vendar pa za spodbujanje mehanizma omenjene reakcije potrebujejo kislino ali osnovno okolje:
Rcoor ' + H2Tudi RCOOh + R'oH
(Kisla polovica)
Molekula vode se doda v karbonilno skupino, c = o. Kislinska hidroliza se povzema pri zamenjavi vsake r 'alkoholne komponente z OH iz vode. Upoštevajte tudi, kako se ester "zlomi" v svojih dveh komponentah: karboksilna kislina, rcooh in r'oh alkohol.
Rcoor ' + Oh- => RcoTudi- + R'oH
(Osnovni medij)
Ko se v osnovnem mediju izvaja hidroliza, se pojavi nepopravljiva reakcija, znana kot saponifikacija. To je zelo zaposleno in je temelj pri izdelavi obrtnih ali industrijskih mil.
RCOO- To je karboksilatni anion, stabilen, ki je elektrostatično povezan s prevladujočim kationom na sredini.
Če je uporabljena osnova NaOH, se tvori sol. Ko je ester triglicerid, ki po definiciji ima tri R stranske verige, tvorijo tri soli maščobnih kislin, rcoon in glicerol alkohol.
Reakcija redukcije
Estri so zelo oksidirane spojine. To pomeni, da ima več kovalentnih vezi s kisikom. Z odstranitvijo vezi C-O pride do prekinitve, ki na koncu loči kislinske in alkoholne sestavine; In še več, kislina se zmanjša na manj oksidiran način, na alkohol:
Rcoor '=> rch2Oh + r'oh
To je reakcija redukcije. Potrebno je močno reducirajoče sredstvo, kot sta litij in aluminijev hidrid, Lialh4, in kislega medija, ki spodbuja migracijo elektronov. Alkoholi so najmanjše oblike, torej tiste, ki imajo manj kovalentne vezi s kisikom (samo ena: C-OH).
Dva alkohola, RCH2Oh + r'oh, prihajajo iz dveh verig prvotnega estra rcoor '. To je metoda sinteze alkoholov z vrednostjo iz njegovih estrov.
Na primer, če bi želeli izdelati alkohol eksotičnih estrov, bi bila to dobra pot v ta namen.
Reakcija transterifikacije
Estri se lahko spremenijo v druge, če reagirajo v kisle ali osnovne medije z alkoholi:
Rcoor ' + R "Oh RCOAli " + R'oH
Struktura estra
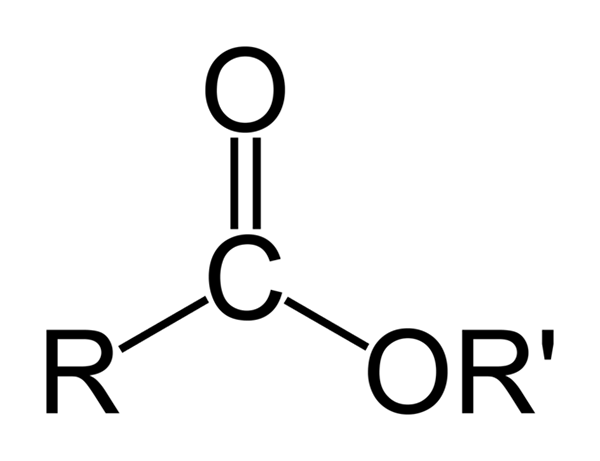 Splošna kemična struktura organskih estrov. Vir: Ben Mills prek Wikipedije
Splošna kemična struktura organskih estrov. Vir: Ben Mills prek Wikipedije Vrhunska slika predstavlja splošno strukturo vseh organskih estrov. Upoštevajte, da R, karbonilna skupina C = O, ali 'tvorijo ploski trikotnik, produkt hibridizacije SP2 osrednjega ogljikovega atoma. Vendar lahko drugi atomi sprejmejo druge geometrije, njihove strukture pa so odvisne od lastne narave r ali r '.
Vam lahko služi: nitrati: lastnosti, struktura, nomenklatura, usposabljanjeČe so r ali r 'preproste verige alqulicas, na primer tipa (izberite2)nPogl3, V vesolju boste izgledali cigzagueada. To je primer pentilo butanoat3Pogl2Pogl2Cooch2Pogl2Pogl2Pogl2Pogl3.
Toda v katerem koli od ogljikov teh verig je mogoče najti vejo ali nenasičenje (C = C, C≡C), ki bi spremenila globalno strukturo estra. In zaradi tega njegove fizikalne lastnosti, kot so topnost in njegove vrelišča in fuzijske točke, se spreminjajo z vsako spojino.
Na primer, nenasičene maščobe imajo dvojne povezave v svojih R verigah, ki negativno vplivajo na medmolekularne interakcije. Kot rezultat, se njihova tališča spuščajo, dokler niso tekoča ali olja pri sobni temperaturi.
Acceptor vodikovega mostu
Čeprav podoba okostja ester izstopa bolj, so verige R in R, ki so odgovorni za raznolikost v njihovih strukturah.
Vendar je za trikotnik zaslužna strukturna značilnost estrov: to so akceptorji vodikovega mostu. Kot? S kisikom karbonilnih in alcoksidnih skupin (-Or ').
Ti imajo pare prostih elektronov, ki lahko pritegnejo delno pozitivne vodikove atome molekul vode.
Zato gre za posebno vrsto interakcij dipol-dipola. Molekule vode se približajo estri (če verige r o r ne preprečujejo in se mostovi oblikujejo c = o-h2Ali ali oh2-O-r '.
Nomenklatura estrov
Za ustrezno ime estra je potrebno. Tudi vsaka možna veja, substituent ali nenasičenost.
Ko to storite, je dodano ime R 'alcoxide Group -or' pripona -ilo, Medtem ko je veriga skupine Carboxilo -Coor R, pripona -Ato. Najprej je omenjen razdelek R, ki mu sledi beseda 'of' in nato ime razdelka R '.
Na primer CHO3Pogl2Pogl2Cooch2Pogl2Pogl2Pogl2Pogl3 Na desni strani ima pet ogljikov, to so tisti, ki ustrezajo r '. Na levi strani pa so štirje ogljični atomi (vključno z karbonilno skupino C = O).
Zato je R 'pentil skupina in R a butan (za vključitev karbonila in upoštevanje glavne verige). Nato je, če želite povedati spojino, dovolj, da dodate ustrezne pripone in jih poimenujete v pravilnem vrstnem redu: butaneAto pentailo.
Kako poimenovati naslednjo spojino: ch3Pogl2Cooc (ch3)3? Veriga -c (cho3)3 ustreza rekto-butil alkilični substituent. Ker ima leva stran tri ogljike, je "propan". Njegovo ime je takrat: propanAto TERT-ailo.
Kako nastajajo estri?
Esterifikacija
Obstaja veliko poti za sintezo estra, nekatere pa so lahko celo nove. Vendar se vsi zbližajo v dejstvu, da mora biti trikotnik slike strukture oblikovan, to je povezava Co-O. Za to se mora začeti iz spojine, ki ima prej karbonilno skupino: kot karboksilna kislina.
In kaj naj bo karboksilna kislina povezana? Alkoholu, sicer ne bi imel alkoholne sestavine, ki bi bila značilna za estre. Vendar karboksilne kisline potrebujejo toploto in kislost, da se reakcijski mehanizem nadaljuje. Naslednja kemična enačba predstavlja zgoraj:
Vam lahko služi: aluminijski hidrid (ALH3): struktura, lastnosti, uporabeRcooh + r'oh rcoor ' + h2Tudi
(Kisla polovica)
To je znano kot esterifikacija.
Na primer, maščobne kisline se lahko esterifirajo z metanolom, CHO3Oh, nadomestiti svoje kisline z metilnimi skupinami, tako da lahko to reakcijo obravnavamo tudi kot metilacija. To je pomemben korak pri določanju profila maščobnih kislin nekaterih olj ali maščob.
Esteres iz kislih kloridov
Drug način za sintezo estrov je iz acil kloridov, rcocl. V njih se namesto, da bi zamenjali hidroksilno skupino OH, nadomestimo atom CL:
Rcocl + r'oh => rcoor ' + hcl
In za razliko od sterifikacije karboksilne kisline se voda ne sprosti, ampak klorovodikova kislina.
Druge metode so na voljo v svetu organske kemije, kot je oksidacija Bayer-Villiger, ki uporablja peroksi kisline (RCOOOH).
Estres uporabe
 Esteres se uporabljajo za različne stvari, na primer izdelavo sveč
Esteres se uporabljajo za različne stvari, na primer izdelavo sveč Med glavno uporabo estrov so:
- V izdelavi sveč ali sveč, kot je vrhunska slika. V ta namen se uporabljajo zelo dolgi stranski verižni estri.
- Kot konzervansi zdravil ali hrana. To je posledica delovanja parabenov, ki niso nič drugega kot estere para-hidroksibenzojske kisline. Čeprav ohranjajo kakovost izdelka, obstajajo študije, ki dvomijo o njenem pozitivnem vplivu na telo.
- Služijo za izdelavo umetnih dišav, ki posnemajo vonj in okus številnih sadja ali cvetov. Tako da so estri prisotni v dobrotah, sladoledu, parfumih, kozmetiki, milih, šamponih, med drugimi komercialnimi izdelki, ki zaslužijo arome ali privlačne okuse.
- Estri lahko zagotovijo tudi pozitiven farmakološki učinek. Zaradi tega se je farmacevtska industrija posvetila sintezi estrov, ki izhajajo iz kislin, prisotnih v telesu, za oceno morebitnega izboljšanja pri zdravljenju bolezni. Aspirin je eden najpreprostejših primerov teh estrov.
- Tekoči estri, kot je etil acetat, so ustrezna topila za nekatere vrste polimerov, kot so nitroceluloza in širok razpon smol.
Primeri estrov
Nekateri dodatni primeri estri so naslednji:
- Butanato de pentilo, ch3Pogl2Pogl2Cooch2Pogl2Pogl2Pogl2Pogl3, ki diši po albikoku in hruške.
- Vinil acetat, cho3Cooch2= Pogl2, iz katerega se pojavlja polivinil acetat.
- Isopentilo pentanoato, ch3Pogl2Pogl2Pogl2Cooch2Pogl2Ch (pogl3)2, ki posnema okus jabolk.
- Etil propanoat, ch3Pogl2Cooch2Pogl3.
- Propil metanoat, hcooch2Pogl2Pogl3.
Reference
- T.W. Graham Solomons, Craight B. Fryhle. Organska kemija. (Deseta izdaja, str. 797-802, 820) Wiley Plus.
- Carey, f. Do. Organska kemija (2006) Šesta izdaja. MC Graw Hill uredništvo-
- Kemija librettexts. Nomenklatura ESERS. Okrevano od: kem.Librettexts.org
- Admin. (19. septembra 2015). Estri: njena kemična narava, lastnosti in uporabe. Vzet iz: čisto-kemijsko.com
- Organska kemija v našem vsakdanjem življenju. (9. marec 2014). Kakšne so uporabe estrov? Pridobljeno iz: gen2Chemistassignment.Weebly.com
- Kemika.Net (2018). Primeri estrov. Okrevano od: KEMIKI.mreža
- Paz María de Lourdes Cornejo Arteaga. Glavne aplikacije estrov. Vzet od: uaeh.Edu.mx
- Jim Clark. (Januar 2016). Uvod ester. Vzet od: Chemguide.co.Združeno kraljestvo

