Struktura kristalnih trdnih snovi, lastnosti, vrste, primeri

- 1240
- 332
- Roman Schamberger
The Kristalne trdne snovi So tisti, katerih mikroskopske strukture so urejene in ubogajo značilen vzorec za določeno kristalno omrežje; Na primer: kubični, šesterokotni, triklinični, Rhomboédrica, med drugim.
Govori se, da te trdne snovi obstajajo kot kristali, ki prikazujejo vidike in geometrijske zasnove, ki odražajo, kako so urejeni v notranjosti. Drugi primeri kristalnih trdnih snovi so diamant, kremen, antracen, suh led, kalijev klorid ali magnezijev oksid.
 Kristalni bar zločinov. Vir: Pixabay.
Kristalni bar zločinov. Vir: Pixabay. Par zelo znanih kristalnih trdnih snovi je sladkor in sol (NaCl). Na prvi pogled oba nosita bele kristale; Toda njegove lastnosti se močno razlikujejo. Sladkor je molekularna kristalna trdna snov, sol pa ionska kristalna trdna. Prvo je sestavljeno iz molekul saharoze; In drugi, na ioni+ in Cl-.
Zgornja slika vam omogoča, da pogledate, kako svetli so lahko kristali sladkorja. Solni kristali, vendar ne zaostajajo. Čeprav sladkor in sol izgledata kot bratje, so njihove strukture drugačne: sladkor, ki postane saharoza, ima monoklinično strukturo; Medtem ko sol, kubična struktura.
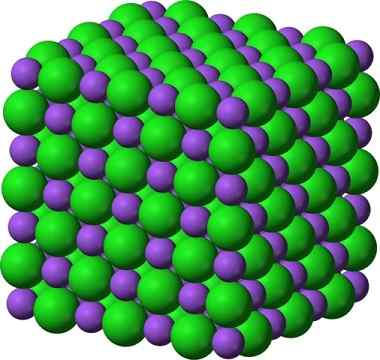 Kristalna struktura natrijevega klorida, NaCl
Kristalna struktura natrijevega klorida, NaCl Razpršeni sladkor in sol (GLA) ostanejo kristalni; Njegovi kristali so postali le veliko manjši za naše oči. Kristalnost trdne snovi je torej bolj definirana z notranjo strukturo, kot z zunanjim videzom ali njenimi bleščicami.
[TOC]
Struktura kristalnih trdnih snovi
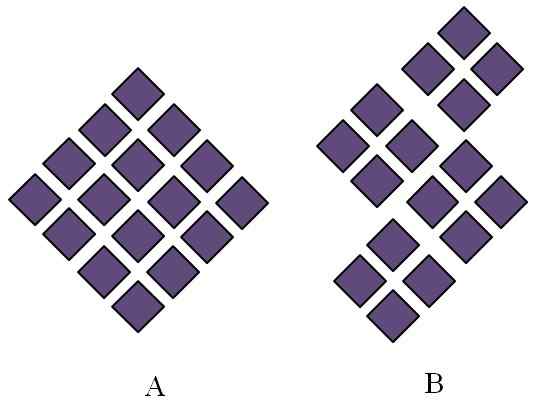 Urejene strukture kristalnih trdnih snovi. Vir: Gabriel Bolívar.
Urejene strukture kristalnih trdnih snovi. Vir: Gabriel Bolívar. Kristalne trdne snovi imajo urejene strukture. Njegove geometrijske značilnosti bodo odvisne od vrste kristalnega omrežja, ki ji pripadajo, kar pa je zunaj projicirano v oblikah kristala (kristalni sistem). Vrhunska slika ponazarja dva pomembna koncepta takšnih struktur: periodičnost in kristalna zrna.
Vam lahko služi: faza razprševanjaProstorski sistem delcev kristalne trdne snovi je časopis; to pomeni, da se vedno znova ponavlja v vseh smereh. To povzroča svoj strukturni vzorec za vsako trdno in kristalno mrežo; Na primer, tu se sol in sladkor začneta razlikovati po njegovi kemični naravi.
V rombusih jim je naročeno, da sprožijo rombo večjih razsežnosti. Vsak vijolični romb predstavlja delček ali niz njih (atomi, ioni ali molekule). Tako bi lahko pričakovali, da ima makroskopski kristal A Rhomboédica videz.
Medtem so v B rombusi urejeni tako, da izvirajo iz kristalnih zrn; To so zelo majhni kristali (kristaliti). Nato je rečeno, da je B poliristalna trdna trdnost; to pomeni, da ga tvori več kristaliti aglomeracije.
Za zaključek je lahko trdna snov preprosto kristalna (a) ali poliristalin (b); V obliki kristalov, medtem ko B Poliristales.
Lastnosti
Lastnosti kristalnih trdnih snovi so odvisne od vrste stekla. Znano je, da so njihove strukture urejene in da običajno predstavljajo tudi briljantne frakcije, ki se zaljubijo v ljubitelje mineralov. Vendar je bilo omenjeno, da je trdno prašno, vključno z "OFF", mogoče uvrstiti tudi kot kristalno.
Način, kako so njihovi delci prostorsko usmerjeni, jim omogoča, da imajo nekaj pomembnih lastnosti za njihovo karakterizacijo. Na primer, kristalne trdne snovi so sposobne difraktirati x -roys, kar ustvarja difrakcijske spektre, iz katerih je mogoče določiti mikroskopsko strukturo kristala.
Tudi zato, ker je struktura periodična, se toplota širi enako na trdni snovi; Dokler ni vmes nečistoč. Tako so tališča za kristalno trdno trdno snov konstantna in se ne razlikujejo ne glede na to, kako so merili.
Lahko vam služi: Gallium: Lastnosti, struktura, pridobivanje, uporabeVrste kristalnih trdnih snovi
Vrste kristalnih trdnih snovi temeljijo na tem, kateri del delcev ga sestavljajo in kakšne so njihove interakcije ali povezave. Obstajajo štiri vrste: ionske, kovinske, molekularne in kovalentne mreže.
Tudi ko predstavljajo določeno stopnjo nečistoč, so še naprej kristalni, čeprav so njihove lastnosti prizadete in ne kažejo enakih pričakovanih vrednosti za čisto trdno snov.
Ionska
Sol je primer ionske kristalne trdne snovi, saj je sestavljena iz Na ionov+ in Cl-. Zato v tej vrsti trdnih snovi ureja ionska vez: elektrostatične sile urejajo strukturni red.
Kovina
Vsi kovinski atomi tvorijo kovinske kristale. To pomeni, da je na primer srebrna vilica konglomerat spojenih srebrnih kristalov. Notranja ali mikroskopska struktura je enaka na vsaki dlani predmeta in ostane nespremenjena od ročaja vilice do konice zob.
Molekularna
Slad. Zato to vrsto trdne snovi sestavljajo molekule, ki jim s svojimi medmolekulskimi interakcijami (in ne -kovalentnimi vezmi) uspejo vzpostaviti urejeno strukturo.
Kovalentne mreže
Končno imamo kristalne trdne snovi kovalentnih omrežij. Prevladujejo kovalentne vezi, saj so odgovorni za določitev reda in vzdrževanje atomov, ki so močno pritrjeni v njihovih prostoru. Ni govora o ioni, atomih ali molekulah, ampak o treh dimenzionalnih omrežjih.
Primeri
Naslednji in na koncu bo za vsako vrsto kristalnih trdnih snovi navedenih nekaj primerov.
Vam lahko služi: elektronegativnostIonska
Vse soli so ionske trdne snovi. Obstajajo tudi sulfidi, hidroksidi, oksidi, halogenidi in druge spojine, ki jih tvorijo tudi ioni, ali njihove interakcije so v ionskem bistvu. Imamo:
-KCl
-Ovitek4
-Ba (oh)2
-Cuso4
-FECL3
-Na2S
-MgO
-Caf2
-Nahco3
-(NH4)2Cro4
Poleg teh primerov se velika večina mineralov šteje za ionske kristalne trdne snovi.
Kovina
Vsak kovinski element je naravno predstavljen kot kovinski kristali. Nekateri od njih so:
-baker
-Likalnik
-Aluminij
-Krom
-Kovinski vodik (pod nepredstavljivimi pritiski)
-Volfram
-Cirkonij
-Titan
-Magnezij
-Natrij
Molekularna
Obstajajo široke palete molekulskih kristalnih trdnih snovi. Skoraj vsaka organska spojina, ki utrdi, uspe vzpostaviti kristale, če je njegova čistost visoka ali če njegova struktura ni preveč zapletena. Torej imamo:
-Led (h2Da)
-Suh led (co2)
-Yo2
-Str4
-S8 (in njegovi polimorfi)
-Antracena
-Trden kisik
-Trden amoniak
-Fenolftalein
-Benzojska kislina
Kovalentne mreže
In končno, med nekaterimi kristalnimi trdnimi snovmi kovalentnih omrežij imamo:
-Diamant
-Grafit
-Ogljikove nanocevke
-Fullerenos
-Kremen
-Silicij
-Germanium
-Bonski nitrid
Na tem seznamu bi lahko ogljikove nanocevke in fulerene obravnavale tudi kot molekularne kristalne trdne snovi. To je zato, ker so sestavljeni iz kovalentno združenih ogljikovih atomov, definirajo enote, ki jih je mogoče vizualizirati kot makromolekule (nogometne kroglice in cevi).
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Kristal. Pridobljeno iz: v.Wikipedija.org
- Kemija librettexts. (16. junij 2019). Kristalne in amorfne trdne snovi. Okrevano od: kem.Librettexts.org
- Rachel Bernstein in Anthony Carpi. (2020). Lastnosti trdnih snovi. Okrevano od: Visionlearning.com
- « Amorfna struktura trdnih snovi, lastnosti, primeri
- Demografski vzroki, posledice, prednosti, slabosti, slabosti »

