Zgodovina selena, lastnosti, strukture, pridobivanje, uporabe

- 3901
- 24
- Cary Goyette
On selen To je nemetalna kemikalija, ki spada v skupino 16 periodične tabele in jo predstavlja simbol. Ta element ima vmesne lastnosti med žveplom in telurio, ki so člani iste skupine.
Selen je leta 1817 odkril Jöhs J. Berzelius in John G. Gahn, ki je izhlapeval pirit, je opazoval rdeči ostanek (spodnja slika). Sprva so ga zamenjali s telurio, a so nato spoznali, da se soočajo z novim elementom.
 Steklenica z amorfnim rdečim selenom, najbolj znana alotropna za ta element. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Steklenica z amorfnim rdečim selenom, najbolj znana alotropna za ta element. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Berzelius je nov element označil za Selenium, ki temelji na imenu "Selene", kar pomeni "Moon Boginja". Selen je bistvena sled za rastline in živali, čeprav je v visokih koncentracijah strupen element.
Selen ima tri glavne alotropne oblike: rdeče, črno in sivo. Slednji ima lastnost spreminjanja njegove električne prevodnosti na podlagi intenzivnosti svetlobe, ki jo seva (fotoprenduktor), zato je imela veliko aplikacij.
Selen je široko razširjen v zemeljski skorji, vendar minerali, ki ga vsebujejo.
V glavnem ga dobimo kot sekundarni produkt procesa rafiniranja s pomočjo bakrene elektrolize. Selen se kopiči v sluzi, ki je na anodi elektroliznih celic.
Človeška bitja imajo približno 25 seleenoproteinov, od katerih nekateri izpolnjujejo antioksidativno delovanje in nadzorujejo generiranje prostih radikalov. Obstajajo tudi selenske aminokisline, kot sta selenometin in selenocistein.
[TOC]
Zgodovina
Prvo opazovanje
Alkimist Arnold iz Villanove je morda opazil selen leta 1230. To je nastalo v medicini v pariškem sorboni in je bil celo doktor papeža Clemente V.
Villanova v svoji knjigi Rosarium Philosophorum Opišite rdeč žveplo ali "žveplovo rebole", ki je ostalo v peči. Ta rdeč žveplo bi lahko bil alotropski selen.
Odkritje
Leta 1817 sta Jöhs Jakob Berzelius in John Gottlieb Gahn odkrila selen v kemični elektrarni za proizvodnjo žveplove kisline v bližini Gripsholma, Švedska. Surovina za izdelavo kisline je bila pirit, ki je izvlečena iz rudnika Falun.
Berzelius je prizadel obstoj rdečega ostanka, ki je ostal v svinčni zabojnici, potem ko je žveplo požgal.
Tudi Berzelius in Gahn sta opazila, da ima rdeči ostanek močan vonj po začinjeni redkvici, podobno tistemu, ki ga je predstavil Telurio. Razlog, zakaj je pisal svojemu prijatelju Marect, da verjamejo, da je opazovani polog telurio.
Vendar je Blelius še naprej analiziral deponirano gradivo s sežiganjem pirita in ponovno preučil, da Telurio v Falunu ni bilo mogoče najti. Februarja 1818 je zaključil, da je odkril nov element.
Izvor vašega imena
Berzelius je poudaril, da je bil novi element kombinacija žvepla in telurio in da mu je podobnost Telurio z novim elementom dala priložnost, da poimenuje novo snov Selenium.
Berzelius je pojasnil, da "Tellus" pomeni boginjo zemlje. Martin Klaport je leta 1799 to ime postavil Teluriu in zapisal: "Noben element se ne imenuje le tako. To je bilo treba storiti!".
Zaradi podobnosti Telurio z novo snovjo ga je Berzelius poklical z besedo Selenium, ki izhaja iz grške besede "Selene", kar pomeni "boginja lune".
Razvoj vaših aplikacij
Leta 1873 je Willoughby Smith odkril, da je električna prevodnost, ki jo je predstavil selen. Ta lastnost je omogočila, da ima Selenium številne aplikacije.
Aleksander Graham Bell je leta 1979 v svojem fotofonu uporabil selen. Selenium proizvaja električni tok, sorazmerni z intenzivnostjo svetlobe, ki jo osvetljuje z uporabo v merilnikih svetlobe, varnostnih mehanizmov za odpiranje in zapiranje vrat itd.
Uporaba selenskih usmernikov v elektroniki se je začela od tridesetih let prejšnjega stoletja, s številnimi komercialnimi aplikacijami. V 70. letih prejšnjega stoletja so ga nadomestili v usmerniki za silicij.
Leta 1957 je bilo ugotovljeno, da je Selenium bistveni element za življenje sesalcev, saj je bil prisoten v encimih, ki ščitijo pred reaktivnim kisikom in prostimi radikali. Poleg tega smo odkrili obstoj aminokislin, kot je selenomecija.
Fizikalne in kemijske lastnosti
Videz
Za selen je več alotropov, njihov fizični videz se razlikuje. Običajno je predstavljen kot rdečkasto trdno snov v obliki prahu.
Standardna atomska teža
78.971 u
Atomsko število (z)
3. 4
Tališče
221 ° C
Vrelišče
685 ° C
Gostota
Gostota selena se razlikuje glede na alotropno ali polimorf. Nekatere njegove določene gostote pri sobni temperaturi so:
Siva: 4.819 g/cm3
ALFA: 4,39 g/cm3
Steklovino: 4,28 g/cm3
Tekoče stanje (tališče): 3,99 g/cm3
Fuzijska toplota
Siva: 6,69 kJ/mol
Toplota za uparjanje
95,48 kJ/mol
Molarna kalorična sposobnost
25.363 j/(mol · k)
Oksidacijske številke
Selen je lahko povezan v njegovih spojinah, ki kažejo naslednje številke ali oksidacijska stanja: -2, -1, +1, +2, +3, +4, +5, +6. Med njimi so najpomembnejši -2 (2-), +4 (vem4+) in +6 (vem6+).
Vam lahko služi: preprost mikroskopNa primer v SEO2 Selen ima +4 oksidacijsko številko; to pomeni, da je obstoj kationa4+ (On4+Tudi22-). Podobno kot SEO3 Selen ima +6 oksidacijsko številko (i6+Tudi32-).
V vodik Seleniuro, h2SE, selen ima oksidacijsko število -2; to je spet obstoj iona ali aniona2- (H2+On2-). To je zato, ker je selen bolj elektronegativen kot vodik.
Elektronegativnost
2,55 na lestvici Pauling.
Ionizacijska energija
-Prvi: 941 kJ/mol.
-Drugi: 2.045 kJ/mol.
-Tretjič: 2.973,7 kJ/mol.
Magnetni vrstni red
Diamagnet.
Trdota
2.0 na lestvici MOHS.
Izotopi
Obstaja pet naravnih in stabilnih izotopov selena, ki so prikazani spodaj z njihovimi številčnostmi:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropija
 Črna steklenica, prevlečena s tankim filmom Selenium Grey. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Črna steklenica, prevlečena s tankim filmom Selenium Grey. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Selen, pripravljen v kemičnih reakcijah, je opečni rdeč amorfni prah, ki ob ustanovitvi črne oblike stekla, podobno kot rosario računi (vrhunska slika). Črni selen je krhka in bujna trdna snov.
Poleg tega je črni selen v ogljikovem sulfidu rahlo topen. Ko se ta raztopina segreva pri 180 ° C, se sivi selen obori, je najbolj stabilen in gosto alotropno.
Sivi selen je odporen proti oksidaciji in je inerten na delovanje ne -oksidirajočih kislin. Glavna lastnost tega selena je njegova fotoprevodnost. Osvetlitev poveča svojo električno prevodnost za faktor 10 do 15 -krat.
Reaktivnost
Selen v njegovih spojinah obstaja v stanjih oksidacije -2, +4 in +6. Manifestira jasno težnjo po tvorbi kislin v višjih oksidacijskih stanjih. Spojine, ki imajo selen z oksidacijskim stanjem -2, se imenujejo seleniuros (2-).
Reakcija vodika
Selen reagira z vodikom, da tvori vodik Seleniuro (H2Se), brezbarven, vnetljiv in smrdeč plin.
Reakcija kisika
Selen gori tako, da oddaja modri plamen in tvori selenijev dioksid:
On8 (s) + 8 o2 => 8 SEO2 (S)
Selenijev oksid je polimer, bela in trdna snov. Njegova hidracija proizvaja seleno kislino (h2SEO3). Selen tvori tudi selenijev trioksid (SEO3), Analogno žveplom (tako3).
Reakcija s halogeni
Selen reagira s fluoridom, da tvori selen heksafluoruro:
On8 (s) +24 f2 (g) => 8 SEF6 (L)
Selen reagira s klorom in bromom, da tvori diklorid in disilenijev dibromure:
On8 (s) +4 cl2 => 4 se2Cl2
On8 (s) +4 BR2 => 4 se2Br2
Selen lahko tvori tudi SEF4 in secl4.
Po drugi strani selenij tvori spojine, v katerih se atom selenija pridruži enemu od halogena in drugemu kisiku. Pomemben primer je selenov oksiklorid (SEO2Cl2), S selenom v oksidaciji +6, izjemno močno topilo.
Reakcija s kovinami
Selen reagira s kovinami, da tvori aluminij, kadmij in natrijev seleniuros. Spodnja kemikalija ustreza tvorbi aluminijale seleniuro:
3 SE8 + 16 al => 8 do2On3
Selenitas
Selen tvori soli, znane kot selenitas; Na primer: Srebrna selenit (AG2SEO3) in natrijev selenit (NA2SEO3). To ime je bilo v literarnem kontekstu uporabljeno za prebivalce Lune: Selenitas.
Kisline
Najpomembnejša selenska kislina je tesnilna kislina (h2SEO4). Je močna kot žveplova kislina in se lažje zmanjša.
Elektronska struktura in konfiguracija
- Selen in njegove povezave
Selen ima šest elektronov Valencije, zato se nahaja v skupini 16, enako kot kisik in žveplo. Teh šest elektronov najdemo v 4S in 4P orbitalah, v skladu z njihovo elektronsko konfiguracijo:
[AR] 3D10 4s2 4p4
Zato, tako kot žveplo, tvorita dve kovalentni vezi, da dokončata svoj oktet Valencia; Čeprav ima razpoložljivost svojih 4D orbital, da poveže več kot dva atoma. Tako se trije selenijevi atomi približajo in tvorijo dve kovalentni vezi: se-se-se.
Selen z večjo atomsko maso ima naravno težnjo po oblikovanju struktur, ki jih urejajo kovalentne vezi; Namesto da bi bili razporejeni kot diatomske molekule2, SE = SE, analogen O2, O = o.
- Prstani ali verige
Med molekularnimi strukturami, ki jih sprejmejo atomi selena, lahko na splošno omenjamo dve: prstani ali verige. Upoštevajte, da v hipotetičnem primeru SE3, Atomi še vedno zahtevajo konce; Zato se morajo zaporedoma povezati z drugimi atomi, dokler veriga ni mogoče zapreti v obroču.
Najpogostejši obroči so tisti z osmimi člani ali atomi selena:8 (Krona selenita). Zakaj osem? Ker je manjši obroč, večja bo napetost; To pomeni, da koti njihovih povezav odstopajo od naravnih vrednosti, ki jih postavljajo hibridizacije SP3 (Podobno kot pri Cycloalcanos).
Vam lahko služi: pascal brizgoObstaja osem atomov, ločitev med SE-ATOMS je dovolj, da so njihove povezave "sproščene" in ne "zložene"; Čeprav je kot njegovih povezav 105,7 in ne 109,5. Po drugi strani pa lahko obstajajo manjši obroči: i6 in7.
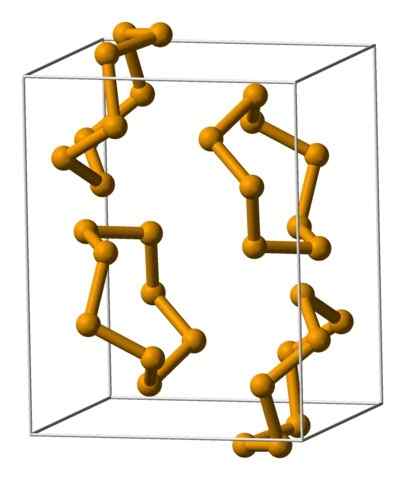 Enote Selenium Analire, predstavljene z modelom kroglic in palic. Vir: Benjah-BMM27 [javna domena].
Enote Selenium Analire, predstavljene z modelom kroglic in palic. Vir: Benjah-BMM27 [javna domena]. Na zgornji sliki so prikazane enote Analeresa8. Upoštevajte podobnost, ki jo imajo z žveplovimi kronami; Samo večji in težki.
Poleg obročev se lahko atomi selenije razporedijo tudi v spiralne verige (pomislite na polževih stopnicah):
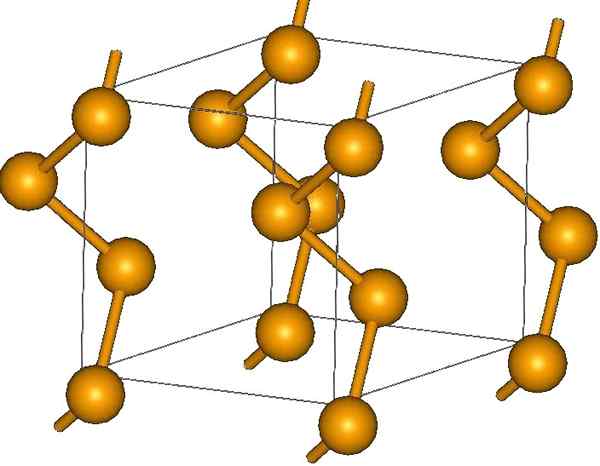 Slikalne verige selenov. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Slikalne verige selenov. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Na njegovih koncih lahko obstajajo dvojne končne povezave (-se = se) ali pa so obroči8.
- Alotropi
Ob upoštevanju, da lahko pride do selenskih spiralnih obročev ali verig in da se lahko njihove dimenzije razlikujejo tudi glede na število atomov, ki jih vsebujejo, potem je razvidno, da je za ta element več kot en alotropni; To so čiste selenske trdne snovi, vendar z različnimi molekularnimi strukturami.
Rdeči selen
Med najvidnejšimi alotropi Selena imamo rdeče, ki jo lahko predstavimo kot amorfni prah, ali kot monoklinični in polimorfni kristali (glej sliko obročev so8).
V amorfnem rdečem selenu so strukture neurejene, brez navideznih vzorcev; Medtem ko so v objektivu, obročki vzpostavljajo monoklinsko strukturo. Kristalni rdeči selen je polimorfni, ki ima tri faze: α, β in γ, ki se razlikujejo po njihovi gostoti.
Črni selen
Struktura črnega selena je sestavljena tudi iz obročev; Toda ne osem članov, vendar še veliko več, obstaja na obroče tisoč atomov (1000). Nato se reče, da je njegova struktura zapletena in je sestavljena iz polimernih obročev; nekateri večji ali majhni od drugih.
Kadar obstajajo polimerni obroči različnih velikosti, je težko čakati, da se vzpostavi strukturni red; Torej je črni selen tudi amorfen, vendar ima v nasprotju z zgoraj omenjenim rdečkastim prahom stekleni kontekst, čeprav je krhko.
Sivi selen
In končno je najpreprostejših alotropov selena siva, ki izstopa nad drugimi, saj je v normalnih pogojih najbolj stabilna in ima tudi kovinski videz.
Njihovi kristali so lahko šesterokotni ali trigonalni, ki jih vzpostavijo londonske disperzijske sile med njihovimi polimernimi spiralnimi verigami (vrhunska slika). Kot njegovih povezav je 130,1 º, kar kaže na pozitiven odstopanje tetraedrskih okolij (z koti 109,5 °).
Zato selenske vijačne verige dajejo vtis, da so "odprte". Zaradi razjasnitve se v tej strukturi soočajo z atomi, zato mora biti teoretično večje prekrivanje njihovih orbitalov, da ustvarijo gonilne pasove.
Toplota s povečanjem molekulskih vibracij škodi tem pasom, ko so verige neurejene; Medtem ko energija fotona neposredno vpliva na elektrone, jih vznemirja in spodbuja njihove transakcije. Iz te vizije si je "enostavno" predstavljati fotoprevodnost za Selenium Grey.
Kje je in proizvodnja
Čeprav je široko razširjen, je Selenium redek element. Je v domačem stanju, povezanem z žveplom in minerali, kot so Eucairita (Cuagse), Cloustalita (PBSE), Naumanit (Ag Ag2SE) in Crookesite [(Cutiag)2On].
Selen je kot nečistoča, ki nadomešča žveplo v majhnem delu kovinskih sulfruznih mineralov; kot so baker, svinec, srebro itd.
Obstajajo tla, v katerih selena obstaja v topni obliki selenata. Te nosijo vode dežja do rek in od tam, proti oceanu.
Nekatere rastline lahko absorbirajo in koncentrirajo selen. Na primer, skodelica oreščkov v Braziliji vsebuje 544 µg selena, kar je enakovredno 777% količine selena, ki ga priporočajo dnevno.
Pri živih bitjih se selen najdemo v nekaterih aminokislinah, kot so: selenomecija, selenocistein in metilsenicystein. Selenocistein in selenit se zmanjšata na vodik Seleniuro.
Bakrena elektroliza
Ni rudarskega izkoriščanja selena. Večino dela dobimo kot sekundarni produkt procesa rafiniranja z bakreno elektrolizo, ki je v blatu, ki se kopiči v anodi.
Prvi korak je sestavljen iz proizvodnje selenijevega dioksida. Za to se zdravi z anodnim tankom z natrijevim karbonatom, da nastane njegova oksidacija. Nato selenski oksid dodamo vodo in ga zakisamo, da tvori selensko kislino.
Končno je selenska kislina z žveplovim dioksidom, da se zmanjša in pridobi osnovni selen.
V drugi metodi v mešanici mulja in blata, ki nastane pri proizvodnji žveplove kisline.
Selenarna kislina in selska kislina se nato tvorijo. Ta selen kislina dobi enako obravnavo kot prejšnja metoda.
Uporablja se lahko tudi klor, ki deluje na kovinski seleniuros za proizvodnjo hlapnih selenskih kloriranih spojin; kot je: vem2Cl2, Sesl4, Sesl2 in SEOCL2.
Vam lahko služi: kemična ravenTe spojine v postopku, ki se izvaja v vodi.
Biološki papir
Pomanjkanje
Selen je bistvena sled za rastline in živali, katerih pomanjkanje pri ljudeh je povzročilo resne motnje, kot je Keshanova bolezen; Bolezen, za katero je značilna poškodba miokarda.
Poleg tega je pomanjkanje selena povezano z moškimi neplodnostjo in lahko igra vlogo pri Kashin-Beck bolezni, vrste osteoartritisa. Prav tako so pri revmatoidnem artritisu opazili pomanjkanje selena.
Encimski kofaktor
Selen je sestavni del encimov z antioksidativnim delovanjem, kot sta glutacija peroksidaza in tiorezodoksin reduktaza, ki delujejo pri izločanju snovi z reaktivnim kisikom.
Poleg tega je Selenium kofaktor ščitničnih hormonov desiodinaze. Ti encimi so pomembni pri uravnavanju delovanja ščitničnih hormonov.
Uporaba selena je bila navedena pri zdravljenju Hasimotove bolezni, avtoimunske bolezni s tvorbo protiteles proti ščitničnim celicam.
Selenium se uporablja tudi za zmanjšanje strupenih učinkov živega srebra, saj se nekatera njena dejanja izvajajo na antioksidativne encime, odvisne od selena.
Beljakovine in aminokisline
Človek ima približno 25 seleenoproteinov, ki izvajajo antioksidativno delovanje za zaščito pred oksidativnim stresom, ki ga sproži presežek reaktivnih kisikovih vrst (ROS) in reaktivnih dušikovih vrst (NI).
Odkrita je bila prisotnost aminokislin selenometitheocin in selenocisteina pri ljudeh. SelenoMectionIn se uporablja kot prehransko dopolnilo pri zdravljenju stanj pomanjkanja selena.
Tveganja
Visoka koncentracija telesa selena ima lahko številne škodljive učinke na zdravje, začenši s krhkimi lasmi in krhkimi nohti, na kožne izpuščaje, toploto, kožni edem in hudo bolečino.
Ko se ukvarjajo s selenom v stiku z očmi, lahko ljudje izrazijo gorenje, draženje in raztrganje. Medtem lahko dolgotrajna izpostavljenost dimu z visoko vsebnostjo selena povzroči pljučni edem, česen dih in bronhitis.
Poleg tega lahko oseba doživi pnevmonitis, slabost, mrzlico, vročino, bolečine v grlu, drisko in hepatomegalijo.
Selen lahko deluje z drugimi zdravili in prehranskimi dodatki, kot so antacidi, antineoplastična zdravila, kortikosteroidi, niacin in tablete za nadzor rojstva.
Selenium je povezan s povečanim tveganjem, da bi se spopadli s kožnim rakom. V raziskavi Nacionalnega inštituta za rak je bilo poudarjeno, da imajo moški z visoko koncentracijo telesa selenija dvakrat bolj verjetnost, da bodo trpeli zaradi agresivnega raka prostate.
Študija kaže, da se dnevni vnos 200 µg selena poveča za 50% možnost razvoja sladkorne bolezni tipa II.
Prijave
Kozmetika
Selenijev sulfid se uporablja pri zdravljenju seboreje, pa tudi maščobnih ali prhljaju.
Zdravniki
Uporablja se kot alternativno zdravilo pri zdravljenju Hasimotove bolezni, avtoimunske bolezni ščitnice.
Selen zmanjšuje toksičnost živega srebra, katerega ena od njegovih strupenih dejavnosti se izvaja na deoksidantnih encimih, ki uporabljajo selen kot kofaktor.
Manganska elektroliza
Uporaba selenskega oksida v elektrolizi mangana znatno zmanjša stroške tehnike, saj se poraba električne energije zmanjšuje.
Pigment
Selen se uporablja kot pigment v slikah, plastiki, keramiki in steklu. Odvisno od selena, ki se uporablja, se barva stekla razlikuje od globoko rdeče do svetlo oranžne.
Fotoprevodni
Zaradi lastnosti sivega selena spreminjanja električne prevodnosti, odvisno od intenzivnosti svetlobe, ki jo seva, je bil selen uporabljen v fotokopirih, fotociperjih, fotometrih in sončnih celicah.
Uporaba selena v fotokopirih je bila ena glavnih aplikacij Selenium; Toda pojav organskih fotoprevodnikov je zmanjšal njeno uporabo.
Kristali
Selen se uporablja za razbarvanje kozarca, kar je posledica prisotnosti železa, ki proizvaja zeleno ali rumeno obarvanost. Poleg tega omogoča rdečo obarvanost stekla, odvisno od uporabe, ki jo želite dati.
Vulkanizacija
Dietenio Dietenium se uporablja kot vulkanizirajoč sredstvo gumijastih izdelkov.
Zlitine
Selen se uporablja v kombinaciji z bizmutom v medenini, da bi nadomestil svinca; Zelo strupeni element, ki je zmanjšal njegovo uporabo zaradi priporočil zdravstvenih agencij.
Selen se doda nizki koncentracijam jekleni in bakreni zlitinam, da se izboljša enostavnost uporabe teh kovin.
Usmerniki
Selenijevi usmerniki so začeli uporabljati leta 1933 do sedemdesetih let prejšnjega stoletja, ko so jih silicij zamenjali z nizkimi stroški in višjo kakovostjo.
Reference
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Okreval od: Raci.org.Au
- Wikipedija. (2019). Selen. Pridobljeno iz: v.Wikipedija.org
- Sato Kentaro. (s.F.). Novi alotropi glavnih skupinskih elementov. [PDF]. Pridobljeno iz: tcichemicals.com
- Doktor. Testo Stewart. (2019). Dejstva o elementih selena. Kemikool. Okrevano od: Chemicool.com
- Robert c. Drzen. (28. avgust 2019). Selen. Encyclopædia Britannica. Okrevano od: Britannica.com
- Marques Miguel. (s.F.). Selen. Okreval od: Nautilus.Fis.UC.Pt
- Čelada, Anne Marie, ph.D. (3. julij 2019). Selenska dejstva. Okreval od: Thoughtco.com
- Lentech b. V. (2019). Tabela obdobja: selen. Okrevano od: Lentech.com
- Tinggi u. (2008). Selen: njegova vloga antioksidanta v zdravju ljudi. Zdravje v okolju in preprečevanje medicine, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Urad prehranskih dopolnil. (9. julij 2019). Selenium: dejstva za zdravstvene delavce. Nacionalni inštitut za zdravje. Pridobljeno iz: sdg.Od.ameriški nacionalni inštitut za zdravje.Gov

