Metil salicilat
- 4146
- 806
- Mr. Shane Larkin
Kaj je metil salicilat?
On metil salicilat Je kemikalija organske narave, ki velja za spojino z večjo strupenostjo med znanimi salicilati, kljub brezbarvnemu in prijetnemu vonju z rahlim sladkim dotikom. Ta vrsta je bolj znana po imenu Galteria Oil. Njegova formula je c8H8Tudi3.
Je v tekočem stanju v standardnih temperaturnih in tlačnih pogojih (25 ° C in 1 atm), ki predstavlja organski ester, ki seveda izvira iz najrazličnejših rastlin. Iz opazovanja in preučevanja njene proizvodnje v naravi je bilo mogoče nadaljevati s sintezo metil salicilata.
Ta sinteza je bila izvedena s kemijsko reakcijo med estrom iz salicilne kisline in njegovo kombinacijo z metanolom. Na ta način je ta spojina del žajblja, belega vina in sadja, kot sta sliva in jabolko, med drugim, ki jih najdemo naravno.
Sintetični, metil salicilat se uporablja pri proizvodnji aromatiziranih sredstev, pa tudi pri določenih obrokih in pijačah.
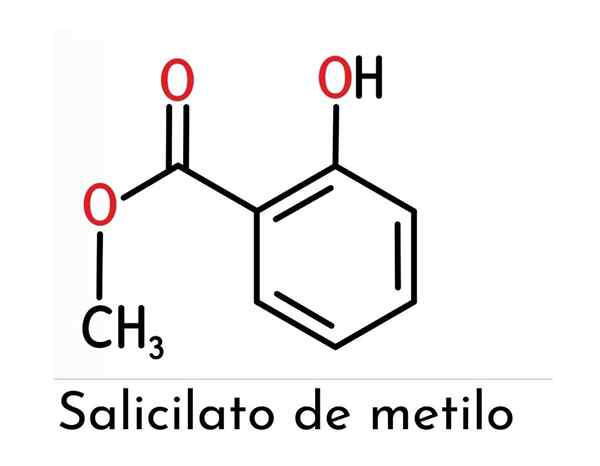
Kemična struktura
Kemična struktura metil salicilata sestavljata dve glavni funkcionalni skupini (ester in fenol, pritrjen na to), kot je prikazano na vrhunski sliki.
Opažamo, da ga sestavljajo vročni obroč (ki predstavlja neposreden vpliv na reaktivnost in stabilnost spojine) iz salicilne kisline.
Če jih poimenujemo ločeno, lahko rečemo, da so združeni v orto (1.2) hidroksilna skupina in metilni ester na prej omenjeni obroč.
Vam lahko služi: terciarni alkohol: struktura, lastnosti, primeriKer je skupina OH povezana z benzenskim obročem, se oblikuje fenol, vendar je skupina, ki ima največ "hierarhije" v tej molekuli.
Tako je njegovo kemijsko ime predstavljeno kot 2-hidroksibenzoat metila, ki ga je podelil IUPAC, čeprav manj pogosto uporabljen, ko se sklicuje na to spojino.
Lastnosti metil salicilat
- To je kemična vrsta, ki spada v skupino salicilatov, ki so proizvodi naravnega izvora iz presnove nekaterih rastlinskih organizmov.
- Obstaja znanje o terapevtskih lastnostih salicilatov pri medicinskih tretmajih.
- Ta spojina je prisotna v nekaterih pijačah, kot so belo vino, čaj, žajbelj in določeno sadje, kot sta papaja ali češnja.
- Seveda ga najdemo v listih velikega števila rastlin, zlasti v določenih družinah.
- Pripada skupini organskih estrov, ki jih je mogoče sintetizirati v laboratoriju.
- Dobimo ga v tekočem stanju, katere gostota je približno 1,174 g/ml v standardnih tlačnih in temperaturnih pogojih (1 atm in 25 ° C).
- Tvori brezbarvno, rumenkasto ali rdečkasto tekočo fazo, ki velja za vodo topno (ki je anorgansko topilo) in v drugih organskih topilih.
- Njegova vrelišče je približno 222 ° C, kar kaže na toplotno razgradnjo okoli 340 do 350 ° C.
- Predstavlja več aplikacij, od aromatizirajočega sredstva v industriji sladkarij do analgetika in drugih izdelkov v farmacevtski industriji.
Vam lahko služi: natrijev azid (nan3): struktura, lastnosti, uporabe, tveganja- Njegova molekularna formula je predstavljena kot c8H8Tudi3 In ima molarno maso 152,15 g/mol.
Uporaba/aplikacije
Zaradi svojih strukturnih značilnosti, ki je metil ester iz salicilne kisline, ima metil salicilat veliko uporab na različnih območjih.
Ena glavnih uporab (in najbolj znanih) te snovi je aromatizirajoče sredstvo v različnih izdelkih: od kozmetične industrije kot dišave do živilske industrije kot arome v sladkarijah (žvečilna guma, bomboni, sladoled, med drugim).
V kozmetični industriji se uporablja tudi kot ogrevalno sredstvo in za mišične masaže v športnih aplikacijah. V zadnjem primeru deluje kot rubefaktor; to pomeni, da povzroča površinsko pordelost kože in membrane sluznice, ko pridete v stik s temi.
Na enak način se uporablja v smetani za lokalno uporabo, za svoje analgetične in protivnetne lastnosti pri zdravljenju revmatičnih stanj.
Druga njegova uporaba vključuje njegovo tekočino na sejah aromaterapije zaradi značilnosti eteričnega olja.
Poleg uporabe kot sredstvo za zaščito pred ultravijoličnim sevanjem pri sončnih kremah se raziskujejo njegove lastnosti pred svetlobo za tehnološke aplikacije, na primer proizvodnja laserskih žarkov ali ustvarjanje občutljivih vrst za shranjevanje informacij v molekulah.
Sinteza metil salicilat
Najprej je treba omeniti, da je mogoče metil salicilat naravno pridobiti iz destilacije vej nekaterih rastlin, kot so galterije (Gaultheria Procumbens) ali sladka breza (Počasna betula).
Lahko vam služi: brez kovin: zgodovina, lastnosti, skupine, uporabeTa snov je bila leta 1843 prvič izvlečena in izolirana po zaslugi znanstvenika francoskega porekla Auguste Cahours; Od Galterije se trenutno pridobiva s sintezo laboratorijev in celo komercialnim.
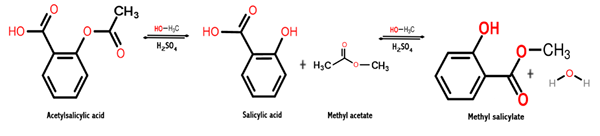
Reakcija, dana za pridobitev te kemične spojine, je postopek, imenovan esterifikacija, v katerem se ester dobi z reakcijo med alkoholom in karboksilno kislino. V tem primeru se pojavi med metanolom in salicilno kislino, kot je prikazano spodaj:
Pogl3OH + C7H6Tudi3 → c8H8Tudi3 + H2Tudi
Treba je opozoriti, da je del molekule salicilne kisline, ki je esterificiran s hidroksilnim (OH) alkoholom.
Torej, to, kar se zgodi med tema dvema kemijskima vrstama, je kondenzacijska reakcija, ker se molekula vode odstrani med reaktanti, medtem ko so druge reakcijske vrste kondenzirane, da dobimo metil salicilat.
Naslednja slika prikazuje sintezo metil salicilata iz salicilne kisline, kjer sta prikazani dve zaporedni reakciji.