Organske soli
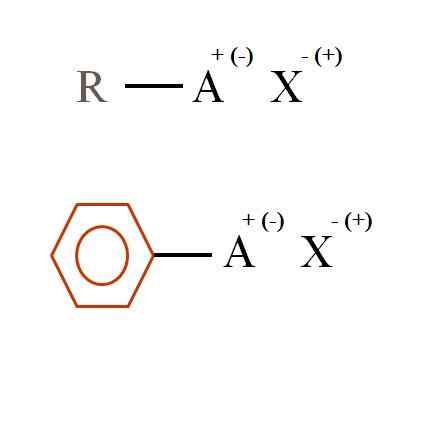
- 3374
- 553
- Lee Farrell
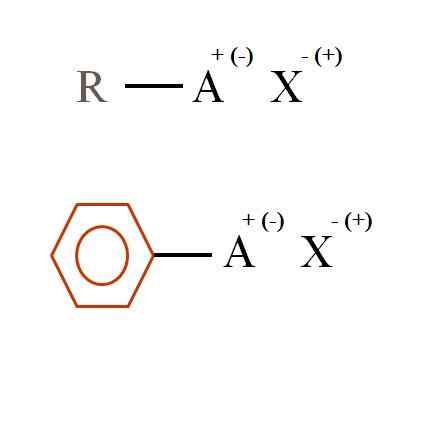 Dve splošni kemični formuli za organske soli. Vir: Gabriel Bolívar
Dve splošni kemični formuli za organske soli. Vir: Gabriel Bolívar Kaj so organske soli?
The Organske soli So gosto število ionskih spojin z neštetimi lastnostmi. Prej izhaja iz organske spojine, ki je bila podvržena preobrazbi, ki omogoča to tovor in da je njegova kemična identiteta odvisna od povezanega iona.
Na vrhunski sliki sta prikazani dve zelo splošni kemični formuli za organske soli. Prvi, R-AX, se razlaga kot spojina, v čigar ogljikovi strukturi atom ali skupina A nosi pozitivno + ali negativno obremenitev (-).
Kot je razvidno, obstaja kovalentna vez med R in A, R-A, vendar ima v zameno formalno obremenitev, ki privabi (ali odbija) v ion x. Znak obremenitve bo odvisen od narave A in kemičnega okolja.
Če bi bilo pozitivno, koliko X bi lahko medsebojno sodelovalo? Z enim glede na načelo elektroneutralnosti (+1-1 = 0). Kakšna je identiteta x? Anion x bi lahko bil co32-, Zahtevata dva kationa RA+; Halogenid: f-, Cl-, Br-, itd.; ali celo drugo spojino-. Možnosti so neprecenljive.
Prav tako je lahko organska sol aromatična, ponazorjena v benzenskem rjavem obroču. Bakrena benzoatna sol (ii), (c6H5COO)2CU na primer sestavljata dva aromatična obroče z negativno naloženimi karboksi2+.
Fizikalne in kemijske lastnosti organskih soli
Iz slike je mogoče potrditi, da organske soli so sestavljene iz treh komponent: organskega, r ali ar (aromatični obroč), atoma ali skupinskega nosilca ionske obremenitve A in protiuona x.
Tako kot so kemična identiteta in struktura opredeljeni s takšnimi komponentami, na enak način so njihove lastnosti odvisne od njih.
Iz tega dejstva je mogoče povzeti nekatere splošne lastnosti, ki izpolnjujejo veliko večino teh soli.
Lahko vam služi: Oksidacijska številka: koncept, kako to izvleči in primereVisoke molekularne mase
Ob predpostavki, da imajo mono ali vsestranske anorganske anione, organske soli običajno veliko večje molekularne mase kot anorganske soli. To je predvsem posledica gaziranega okostja, katerega preproste C-C vezi in njeni vodikovi atomi zagotavljajo veliko mase do spojine.
Zato so tisti, ki so odgovorni za svoje visoke molekulske mase.
Amfifilne in površinsko aktivne snovi
Organske soli so amfifilne spojine, torej njihove strukture imajo tako hidrofilne kot hidrofobne skrajnosti.
Kaj so takšne skrajnosti? R ali AR predstavljata hidrofobni konec, ker njuna atoma C in H nimajo velike afinitete do molekul vode.
Do+(-), Skupina nosilcev atoma ali tovora je hidrofilni konec, saj prispeva k dipolnemu trenutku in sodeluje z dipolom, ki tvori vodo (RA+ Oh2).
Ko se hidrofilna in hidrofobna območja polarizirajo, postane amfifilna sol površinsko aktivna snov, snov, ki se pogosto uporablja za izdelavo detergentov in UNULLAMPING.
Visoke vrelišča ali fuzija
Tako kot anorganske soli imajo tudi organske soli zaradi elektrostatičnih sil, ki upravljajo v tekoči ali trdni fazi, visoke taljenja in vrelišča.
Vendar pa z organsko komponento R ali AR na nek način na nek način z elektrostatičnimi sodelujejo druge vrste van der Waals (London, Dipolo-Dipolo, vodikove mostove) na nek način sodelujejo.
Zaradi tega so trdne ali tekoče strukture organskih soli najprej bolj zapletene in raznolike. Nekateri se lahko celo obnašajo kot tekoči kristali.
Kislost in bazičnost
Organske soli so običajno močnejše kisline ali baze kot anorganske soli. To je zato, ker ima na primer v aminskih soli pozitivno obremenitev zaradi svoje povezave z dodatnim vodikom: a+-H. Nato v stiku z bazo podarite proton, da bo spet nevtralna spojina:
Lahko vam služi: stroncija: zgodovina, struktura, lastnosti, reakcije in uporabeRa+H + b => ra + hb
H pripada A, vendar je napisan, saj vmeša v reakcijo nevtralizacije.
Po drugi strani pa ra+ Lahko je velika molekula, ki ne more tvoriti trdnih snovi s kristalnim omrežjem, stabilno s hidroksilnim anionom ali Oxhidrilo OH-.
Ko je temu tako, solni ovna+Oh- Obnaša se kot močna podlaga; Tudi tako osnovno kot NaOH ali KOH:
Ra+Oh- + Hcl => racl + h2Tudi
V kemični enačbi upoštevajte, da je Anion Cl- Zamenjajte oh-, Oblikovanje soli ra+Cl-.
Uporaba organskih soli
Uporaba organskih soli se bo razlikovala glede na identiteto R, AR, A in X. Poleg tega je uporaba, ki ji je dodeljena, odvisna tudi od vrste trdne ali tekočine, ki jo tvorijo. Nekatere splošnosti v zvezi s tem so:
- Služijo kot reagenti za sintezo drugih organskih spojin. RAX lahko deluje kot "dajalec" verige R, da doda drugo spojino, ki nadomešča dobro odhajajočo skupino.
- So površinsko aktivne snovi, zato jih lahko uporabimo tudi kot maziva. Za ta namen se uporabljajo kovinske karboksilalatne soli.
- Omogočajo sintezo široko paleto barvil.
Primeri organskih soli
Karboksilati
Karboksilne kisline reagirajo s hidroksidom v reakciji nevtralizacije, kar povzroča karboksilalatne soli: rcoo- M+; kjer m+ To je lahko kateri koli kovinski kation (NA+, Pb2+, K+, itd.) ali kation amonijeve4+.
Maščobne kisline so karboksilne kisline z dolgimi verigami, lahko so nasičene in nenasičene. Palmitinska kislina je med nasičenimi (izberite3(Pogl2)14COOH). To izvira iz palmitatne soli, medtem ko stearinska kislina (CHO3(Pogl2)16COOH tvori stearno sol. Mila so sestavljena iz teh soli.
Vam lahko služi: splošni zakon o plinuV primeru benzojske kisline, c6H5Cooh (kjer c6H5- Je benzenski obroč), ko reagira z osnovnim tvorbo soli benzoata. V vseh karboksilatih skupina -co- Predstavlja (RAX).
Litijevi diaquilcupratos
Dan litija je uporaben pri organski sintezi. Njegova formula je [R-CU-R]-Li+, v katerem bakreni atom nosi negativno obremenitev. Tukaj baker predstavlja atom slike.
Sulfonijeve soli
Nastajajo iz reakcije organskega sulfida z alkil halogenidom:
R2S + r'x => r2R+X
Za te soli atom žvepla nosi pozitivno formalno obremenitev+) s tremi kovalentnimi povezavami.
Oxyio soli
Prav tako eterji (kisigenirani analogi sulfidov) reagirajo s hidraceidi, da tvorijo oksiste sobe:
ROR ' + HBR RO+Hr ' + br-
Proton HBR kisline je dosledno povezan z eterskim kisikovim atomom (R2Tudi+-H), zaračunavanje pozitivno.
Amina soli
Amini so lahko primarni, sekundarni, terciarni ali kvartarni, tako kot njihove soli. Za vse je značilno, da ima atom H, povezan z atomom dušika.
Tako RNH3+X- Je primarna aminska sol; R2Nh2+X-, sekundarne amine; R3Nh+X-, terciarnega amina; in r4N+X-, kvartarnega amina (kvartarna amonijeva sol).
Diazonijeve soli
Končno diazonijeve soli (rn2+X-ali arildiazonium (RNA2+X-), predstavljajo izhodišče številnih organskih spojin, zlasti azoičnih barvil.
Reference
- Frančišek a. Želva. Organska kemija (šesta izdaja, pp. 604-605, 697-698, 924). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. Organska kemija. Amine (10. izdaja.). Wiley Plus.
- Wikipedia (2018). Sol (kemija). Vzeto od: v.Wikipedija.org
- Steven a. Hardinger (2017). Ilustrirani slovar organske kemije: soli. Okrevano od: kem.UCLA.Edu
- Chevron Oronit (2011). Karboksilati. [PDF]. Okreval od: Oronit.com

