Značilnosti Takera, struktura, funkcije
- 2231
- 427
- Lee Farrell
The Sakera, Znan tudi kot kompleks tabera-izomaltaze, je membranalni encimski kompleks z aktivnostjo α-glikozilaze, ki pripada skupini celovitih hidrolaz (sestavljen iz glikozidaz in peptidaz).
Prisoten je v črevesnih mikrotovih številnih kopenskih živali, kot so sesalci, ptice in plazilci. Po različnih bibliografskih virih so druga sprejeta imena tega encima oligo-1,6-glukozidaza, α-metil glukozidaza, izomaltaza in oligosaharid α-1,6-glukozidaza.
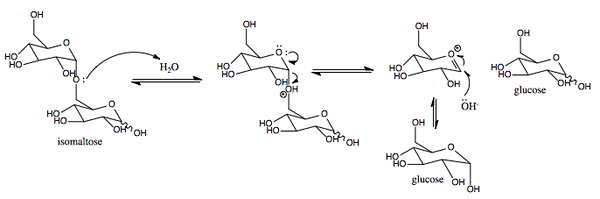
 Grafični prikaz mehanizma delovanja SacAs.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
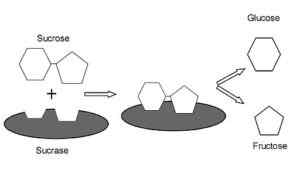
Grafični prikaz mehanizma delovanja SacAs.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) To je encim z aktivnostjo, podobno invertnemu, v rastlinah in mikroorganizmi. Njegova primarna funkcija je hidroliziranje glukozidne vezi med monosaharidi (glukoza in fruktoza), ki sestavljajo saharozo, zaužito s hrano.
Ima zelo pomembne prebavne funkcije, saj saharoze ni mogoče prevažati kot disaharid v črevesne celice, zato njegova hidroliza omogoča črevesno absorpcijo njegovih sestavnih monosaharidov.
Sinteza in aktivnost suitorice-izomaltaze v črevesnih celicah živali je regulirana na številnih ravneh: med transkripcijo in prevajanjem, med glikozilacijo in tudi med post-translacijsko obdelavo.
Ko kateri od teh dogodkov ne uspe ali se v genu, ki ga kodira, pojavi kakšna vrsta mutacije, pri ljudeh obstaja patološko stanje, znano kot sindrom pomanjkanja saharoze, kar je povezano z nemožnostjo presnove disaharidov.
[TOC]
Značilnosti
Disaharidi, ki služijo kot substrat za sesalce pri sesalcih, so ponavadi produkt hidrolitske aktivnosti encimov sline in trebušne slinavke α-amilaze. To je posledica dejstva, da Sacas ne samo hidrolizira glukozidne vezi saharoze, ampak tudi α-1,4 vezi maltoze in maltotrioze ter drugih oligosaharidov.
Polovična življenja istega se giblje med 4 in 16 urami, zato črevesne celice veliko vlagajo.
Vam lahko služi: kakšna je krenacija? (Biologija)Sinteza
Tako kot najupoštovani hidrolazni encimi so tudi Sackwaters (Suitor-Izomaltaza ali da) sintetiziran glikoprotein v ročnih celicah krtače, kot je predhodnik polipeptida.
Ta predhodnika molekula se prevaža na apikalno površino celic in obstaja encimsko obdelana s proteazami trebušne slinavke, ki jo razdelijo na dve različni podenoti: podenota Isomaltaze in Subunidad Subunidad.
Podenota izomaltaze ustreza končnemu amino koncu pro-SI in ima hidrofobni segment (hidrofobno sidro) na svojem n-terminalnem koncu. To vam omogoča, da se s plazemsko membrano črevesnih celic povežete z robom čopiča.
Gen, ki kodira ta kompleks pri ljudeh, se nahaja v dolgi roki kromosoma 3 in glede na veliko homologijo zaporedja med obema podenotama (več kot 40%) je bilo predlagano, da je ta encim nastal s pomočjo genetskega podvajanja.
Dokazano je, da sta obe podenoti, Isomaltaza in SacAs sposobni hidroliz.
Struktura
Začetna oblika encimskega SacA, pro-poli polipeptid, ima približno 260 kDa in 1827 aminokislin. Vendar proteolitična aktivnost proteaz trebušne slinavke proizvaja dve podenoti 140 kDa oziroma 120 kDa, ki predstavljata izomaltazo oziroma sakare.
Ta encim je glikoprotein s saharidnimi deli N- in Tudi-Glikozilade in študije njihovega zaporedja razkrivajo prisotnost več kot 19 mest glikozilacije. Ogljikovi hidratni deli predstavljajo več kot 15% teže beljakovin in so v bistvu sestavljeni iz sinalne kisline, galaktozamina, roke in N-acetilglukozamina.
Vam lahko služi: levcin: značilnosti, struktura, funkcije, biosintezaKer dve podenoti kompleksa za sarazno-izomaltaze nista popolnoma enaka, mnogi avtorji menijo, da je ta encim v resnici heterodimer, kjer vsaka podenota sestavlja glikozilirana linearna polipeptidna veriga in da je povezana z nekovalentnimi povezavami.
Podenota izomaltaze ima hidrofobni segment 20 aminokislinskih odpadkov, ki sodelujejo v njeni povezavi z membrano enterocitov (črevesne celice) in ki predstavljajo stalno sidro in peptidni signal, da gredo do endoplazemskega retikuluma.
Aktivno mesto obeh podenot, SacA in Isomaltaze, najdemo v plazemski membrani enterocitov, ki štrli proti črevesju.
Funkcije
Glavne presnovne funkcije encimov, kot je Suitor-Izomaltaza, so povezane s proizvodnjo glukoze in fruktoze iz saharoze. Monosaharidi, ki se prevažajo v črevesne celice in so vključeni v različne presnovne poti z različnimi nameni.
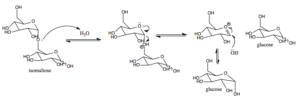 Mehanizem delovanja sladkorja-izomaltaze pri sesalcih (vir: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Mehanizem delovanja sladkorja-izomaltaze pri sesalcih (vir: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Glukoza, za katero obstajajo specifični prevozniki, je mogoče znotrajcelično usmeriti v glikolizo, na primer, kjer njegova oksidacija vodi v proizvodnjo energije v obliki ATP in zmanjšuje moč v obliki NADH.
Fruktozo lahko na drugi strani presnavljamo tudi z vrsto reakcij, ki se začnejo s fosforilacijo na fruktozo 1-fosfat in katalizirajo z jetrno fruktohinazo. To se začne vključitev tega substrata na druge poti proizvodnje energije.
Poleg tega, tako kot pri encimu, obrnjenem v rastline.
Človeške povezane bolezni
Obstaja prirojena avtosomna bolezen pri ljudeh, znanih kot Suitor-Izomaltasa ali CSID (angleščina Priročen primanjkljaj Lindy-Izomaltaze), ki je povezana z napakami pri prebavi oligo in osmotično aktivnih disaharidov.
Vam lahko služi: Ustanovitveni učinekTa bolezen je povezana z več hkratnimi dejavniki, med katerimi je napačen pregon predhodnika pro-IF encima, genetskih mutacij, napak med prevozom itd.
Ta pogoj je težko diagnosticirati, pogosto ga zmedemo z laktozno intoleranco. Zato je znan tudi kot "intoleranca saharoze".
Zanj je značilen razvoj trebušnih krčev, driske, bruhanja, jaquecas, ki jih spremljajo hipoglikemija, pomanjkanje rasti in povečanja telesne mase, tesnoba in prekomerna proizvodnja plinov.
Reference
- Brunner, J., Hauser, h., Braun, h., Wilson, k., Wecker, w., O'Neill, b., & Semenza, g. (1979). Način povezave encimske komplekse ligaze-izomaltaze z mejo meje črevesne ščetke. Časopis za biološko kemijo, 254(6), 1821-1828.
- Cowell, g., Tranum-Jensen, J., Sjöström, h., & Norén, ali. (1986). Topologija in kvartarna struktura pro-sukraze / izomaltaze in Simomrired / Isomaltase v končni obliki. Journal Biochemical, 237, 455-461.
- Hauser, h., & Semenza, g. (1983). Limade-Izomaltaza: zalezovani notranji protein mejne membrane krtače. Kritični pregledi v biohiji, 14(4), 319–345.
- Hunziker, w., Spiess, m., Semenza, g., & Lodish, h. F. (1986). Kompleks limade-lsomaltaze: primarna struktura, orientacija membrane in evolucija zalezanega, notranjega mejnega proteina. Celica, 46, 227-234.
- Naim, h. In., Roth, J., Sterchi, e. In., Lentze, m., Mile, str., Schmitz, J., & Hauril, h. (1988). Primanjkljaj Lind-Isomaltase pri ljudeh. J. Klinika. Investirati., 82, 667-679.
- Rodriguez, i. R., Taravel, f. R., & Whelan, w. J. (1984). Karakterizacija in funkcija prašičje črevesne linde-izomaltaze in njegovih ločenih podenot. EUR. J. Biochem., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, g. (2012). Sladkor. V Ullmannova enciklopedija industrijske kemije (Vol. 34, str. 72). WILEY-VCH VERLAG GMBH & CO. Kgaa.
- Treem, w. (devetnajst devetdeset pet). Priročen primanjkljaj Lindy-Izomaltaze. Časopis za pediatrično gastroenterologijo in prehrano, enaindvajset, 1-14.
- « Značilnosti gastrina, struktura, proizvodnja, funkcije
- 11 glavnih vrst inženiringa in njihove značilnosti »

